Nach dem 1960 von Linus Pauling geschaffenen Orbitalmodell ist die kovalente Bindung, die die Moleküle entsteht durch die Verschmelzung oder Durchdringung unvollständiger Orbitale der an der Verknüpfung. Daraus wird geschlossen, dass ein Element mit einem unvollständigen Orbital (mit nur einem Elektron) nur eine kovalente Bindung eingehen kann. Wenn es zwei unvollständige Orbitale hat, kann es maximal zwei Verbindungen herstellen und so weiter.
Schauen Sie sich jedoch die Atomorbitale des Elements Kohlenstoffatom an, das die Ordnungszahl 6 (Z = 6) hat:
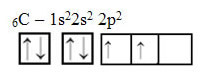
Beachten Sie, dass es zwei unvollständige Orbitale hat, daher sollte es höchstens zwei Bindungen ausführen. Das passiert ihm jedoch nicht. Wie viele wissen, geht Kohlenstoff vier Bindungen ein (es ist vierwertig), daher erklärt dieses Orbitalmodell den Fall von Kohlenstoff nicht.
Um diese Sackgasse zu beenden, wurde eine neue Theorie entwickelt, die dieses Problem besser erklärt: die Hybridisierungstheorie.

Dies bedeutet, dass die Hybridisierung eine „Mischung“ aus reinen Orbitalen ist.
Für Kohlenstoff gibt es drei Arten der Hybridisierung: sp3, sp2 und sp.
Um zu verstehen, wie die Hybridisierung stattfindet, betrachten wir die erste Art der Kohlenstoffhybridisierung, den sp-Typ.3:
Diese Art der Hybridisierung findet im Methanmolekül (CH4). Beachten Sie, dass es zwischen Kohlenstoff, dem zentralen Element, und vier Wasserstoffatomen vier identische kovalente Bindungen gibt. Sehen Sie sich also an, was das unvollständige Wasserstofforbital ist:
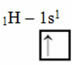
Da jeder Wasserstoff ein unvollständiges Orbital vom s-Typ hat, ist es notwendig, ein Elektron mehr aufzunehmen, dh jedes geht nur eine kovalente Bindung mit dem Kohlenstoff ein. Deshalb muss Kohlenstoff vier unvollständige Orbitale haben. Wie kommt es dazu? Durch Hybridisierung.
Wenn ein Elektron aus dem 2s-Orbital Energie aufnimmt, gelangt es in das leere 2p-Orbital. Daher sagen wir, dass dieser Sprung des Elektrons von der 2s- zur 2p-Unterebene eine „Förderung“ des Elektrons ist. Auf diese Weise bleibt der Kohlenstoff in seinem angeregten oder aktivierten Zustand, wobei vier hybridisierte Orbitale zur Verfügung stehen, um die kovalenten Bindungen auszuführen:
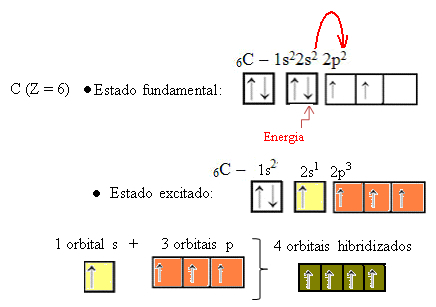
Beachten Sie, dass die gebildeten Hybridorbitale einander äquivalent sind, sich jedoch von den ursprünglichen reinen Orbitalen unterscheiden.
Auf diese Weise erfolgt die Bindung zwischen den s-Orbitalen jedes der vier Wasserstoffatome mit diesen vier hybridisierten Kohlenstofforbitalen:
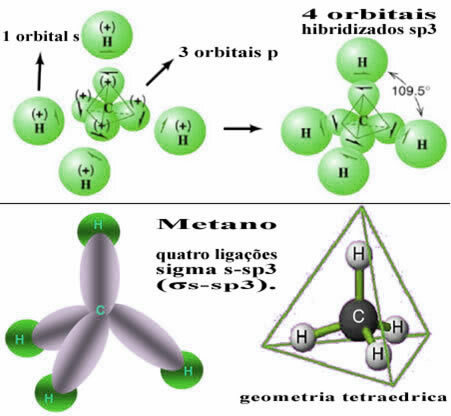
Wie oben zu sehen ist, hat das Methanmolekül eine regelmäßige Tetraederstruktur mit den vier Elektronenwolken an jedem Scheitel und angrenzenden Winkeln von 109°28’. Da die Bindung zwischen einem s-Orbital jedes Wasserstoffs und einem hybridisierten sp-Orbital hergestellt wurde3 für jede Verbindung haben wir, dass sie sind vier Sigma-S-Sp-Links3 (σs-sp3).
Von Jennifer Fogaça
Abschluss in Chemie
Quelle: Brasilien Schule - https://brasilescola.uol.com.br/quimica/hibridizacao-tipo-sp3.htm