Ö Prinzip von Le Chatelier sagt uns, dass, wenn in einem System im Gleichgewicht eine Störung auftritt, es sich in die Richtung verschiebt, die die durch diese Störung erzeugten Kräfte minimiert und ein neues chemisches Gleichgewicht wiederherstellt.
Eine dieser Störungen ist die Temperaturschwankung. Diese Variation ist wichtig, da sie nicht nur die Gleichgewichtsverschiebung verursacht, sondern auch den Wert der Gleichgewichtskonstante K. ändertç.
Um besser zu verstehen, wie dies geschieht, sehen wir uns ein Beispiel an:
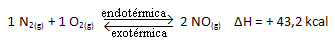
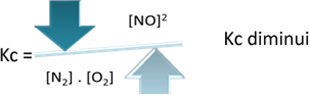
Kç = _[ BEI DER]2___
[Nein2]. [Ö2]
Die obige Reaktion läuft in direkter Richtung mit Energieaufnahme ab, sie ist endotherm. Der umgekehrte Vorgang hingegen läuft unter Energiefreisetzung ab und ist eine exotherme Reaktion.
Wenn wir also die Temperatur des Systems erhöhen, verschiebt sich das chemische Gleichgewicht in Richtung der endothermen Reaktion, die bei dieser Reaktion nach rechts liegt. Dadurch wird die Wärme absorbiert und das Gleichgewicht wiederhergestellt.
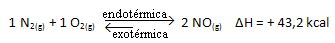
Das Gegenteil ist ebenfalls der Fall; Wenn wir die Temperatur dieses Systems senken, verschiebt sich die Reaktion in die Richtung, in der Wärme freigesetzt wird, da die Gesamtenergie der Reaktion abnimmt. Dies bedeutet, dass sich das Gleichgewicht in Richtung der exothermen Reaktion verschiebt, die in diesem Fall nach links verläuft:
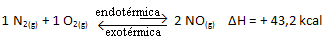
Zusamenfassend:

Bezogen auf die Gleichgewichtskonstante (Kç), wenn die Temperatur steigt, begünstigt dies die endotherme Reaktion und mehr NO(G) gebildet wird, dessen Konzentration erhöht und die Konzentration der Reaktanten verringert wird. Beachten Sie in der Formel unten, dass die NO-Konzentration(G) ist direkt proportional zur Konstanten Kç, daher erhöht es sich auch:
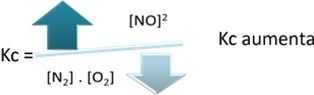
Wenn wir jedoch die Temperatur senken und die Reaktion in Richtung der exothermen Reaktion verschieben, sinkt die Konzentration des NO-Produkts und die Konzentration der Reaktanten nimmt zu. Da die Konzentrationen der Reaktanten umgekehrt proportional zur Konstanten Kc sind, nimmt sie ab:
Von Jennifer Fogaça
Abschluss in Chemie
Quelle: Brasilien Schule - https://brasilescola.uol.com.br/quimica/variacao-temperatura-deslocamento-equilibrio-quimico.htm

