Hybridisierung von sp-Typ-Kohlenstoff2 es tritt auf, wenn es eine Doppelbindung und zwei Einfachbindungen oder eine Pi-Bindung (π) und drei Sigma-Bindungen (σ) hat. Tatsächlich ist die sp-Hybridisierung2 es wird zwischen den Atomen bewirkt, die die Doppelbindung bilden.
Ein Beispiel für ein solches Molekül ist Formaldehyd (CH2Ö). Beachten Sie seine Struktur unten:
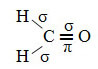
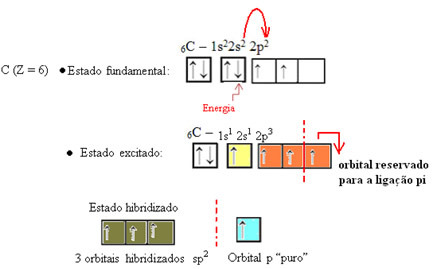
Wie im Text zu sehen "sp-Typ-Hybridisierung3“, tritt Kohlenstoffhybridisierung auf, wenn ein Elektron der Unterebene 2s Energie erhält und zum. transportiert wird 2p-Unterebene und entstammen somit 4 hybridisierten Orbitalen aus der "Mischung" der Atomorbitale rein.
Im Fall von Formaldehyd wissen wir, dass es eine Pi-Bindung geben wird, daher ist eines dieser hybridisierten Orbitale für diese Bindung reserviert, während die anderen drei die Sigma-Bindungen tragen:
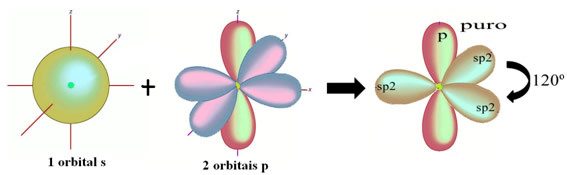
Die Wasserstoffatome, die die Einfachbindung mit Kohlenstoff eingehen, machen es mit ihrem s-Orbital:
Das verbleibende "reine" p-Orbital bindet das Sauerstoffatom und das Formaldehydmolekül hat folgende Struktur:
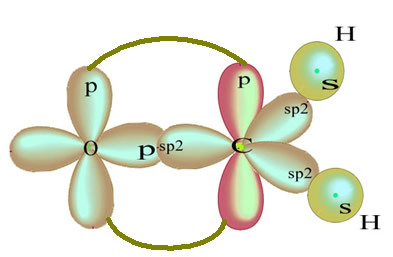
Was die Art der in dieser Formaldehydstruktur vorhandenen Bindungen betrifft, haben wir:

Anschlüsse: 1 = 2 = σs-sp2
3 = σp-sp2
4 =πp-p
Von Jennifer Fogaça
Abschluss in Chemie
Quelle: Brasilien Schule - https://brasilescola.uol.com.br/quimica/hibridizacao-tipo-sp2.htm
