Die Elemente benannt nach Erdalkalimetalle sind diejenigen, die zur Familie 2 oder IIA des Periodensystems gehören. Diese Gruppe umfasst die folgenden chemischen Elemente: Be (Beryllium), Mg (Magnesium), Ca (Calcium), Sr (Strontium), Ba (Barium) und Radium (Ra).

Sie haben zwei Elektronen in der Valenzschale, und ihre allgemeine Verteilung wird durch ns2 dargestellt, wobei Nein stellt die Nummer der letzten Ebene dar. Aufgrund dieser Eigenschaft neigen sie dazu, diese beiden Elektronen zu verlieren, wodurch Kationen mit 2+-Ladung entstehen.
Der Begriff „Erde“ bezieht sich auf „auf der Erde existierend“, da hier diese Elemente hauptsächlich in Mineralien vorkommen. Zum Beispiel Calcium in Form der Calciumphosphatverbindung (Ca3(STAUB4)2), kommt in der Erdkruste vor und dient als Rohstoff für die Phosphorproduktion. Es ist auch in den Knochen von Tieren vorhanden, so dass bei deren Kalzinierung das sogenannte „Knochenmehl“ entsteht, das Calciumphosphat enthält.
Unter den Erdalkalimetallen stechen vor allem die Kalzium es ist das Magnesium.
- Kalzium
Das Calciumion (Ca2+) ist in etwa 90 % unserer Knochen und Zähne vorhanden; und bei Tieren ist es auch in ihren Schalen vorhanden. Seine Funktion besteht darin, die Knochenstruktur zu stärken und als Muskelrelaxans zu dienen. Ein Kalziummangel im Körper kann Muskelkrämpfe, Tetanus und Osteoporose verursachen. Deshalb ist es wichtig, es über kalziumreiche Lebensmittel wie Milch und deren Derivate (Butter, Käse usw.), Fleisch und Gemüse zu sich zu nehmen.
Andererseits kann zu viel Kalzium Muskelentspannung, Nierensteine und Knochenschmerzen verursachen.
Neben den oben genannten Lebensmitteln ist Calcium noch in vielen Teilen der Natur vorhanden, insbesondere in Mineralstoffen wie Calcit (CaCO3) oder Calciumcarbonat, das ein Bestandteil von Kalkstein und Marmor ist, und Marmor wird bei der Herstellung von Waschbecken, Statuen, Fußböden und Treppen verwendet. Calciumcarbonat ist auch der Erbauer von Stalaktiten und Stalagmiten in Höhlen. Calcium ist auch in Naturgips (CaSO4. 2 Stunden2O), genannt Gips. Dieses Salz kann dehydratisiert werden, wodurch CaSO. entsteht4 wasserfrei, das ist Schulkreide.
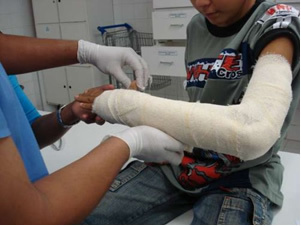
In der Industrie wird Frischkalk (CaO) hergestellt, gelöschter Kalk, auch Kalkhydrat oder gelöschter Kalk genannt, der eigentlich Calciumhydroxid (Ca (OH)2), die in Tünchefarben und bei der Mörtelherstellung verwendet werden. Die schonende Erhitzung des Gipses ermöglicht die Gewinnung des im Bauwesen verwendeten halbhydratisierten Calciumsulfats, das ist Gips Zivilgesellschaft, bei der Herstellung von Formen in der Zahnmedizin und Medizin zum Schutz von Knochenbrüchen, wie unten am Arm.
- Magnesium
das Ion von Magnesium Es hat auch eine große biologische Bedeutung, da es in 70% unserer Knochen vorhanden ist und die Wirkung von Enzymen, Muskeln und motorischer Koordination begünstigt. Sein Mangel im Körper kann Desorientierung, Bluthochdruck, Zittern und einen schwachen Puls verursachen. Daher sollten wir die folgenden Lebensmittel essen, die dieses Element enthalten: Nüsse, Getreide und grünes Gemüse. Außerdem kann ein Überschuss an Magnesium im Körper Schläfrigkeit verursachen.
Magnesium kommt auch in Meerwasser und Mineralien vor. Es wird in metallischen Legierungen wie Opfermetallen (die anstelle von Stahl oxidieren und so dessen Korrosion verhindern), in „Magnesium“-Rädern und in Feuerwerkskörpern (in den Farben Silber und Weiß) verwendet. Eine sehr wichtige Verbindung von Magnesium ist Magnesiumhydroxid (Mg(OH)2), das in Wasser mit einer Konzentration von ca. 7 % dispergiert eine bekannte Suspension ergibt im Volksmund als Magnesiamilch, die als Antazida dient, die Magensäure (Sodbrennen) bekämpft und als Abführmittel.

Von Jennifer Fogaça
Abschluss in Chemie
Quelle: Brasilien Schule - https://brasilescola.uol.com.br/quimica/metais-alcalinoterrosos.htm

