Adsorption ist eine physikalisch-chemische Eigenschaft von Molekülen flüssiger, gasförmiger und fester Stoffe.
Der Prozess tritt auf, wenn flüssige oder gasförmige Partikel auf der Oberfläche von Feststoffen gefangen werden. Sind die Feststoffe porös, erhöht sich die Adsorptionskapazität noch weiter.
Für die am Prozess beteiligten Komponenten gibt es zwei Klassifizierungen:
- Adsorbate: Es ist die flüssige oder gasförmige Substanz, die auf der Oberfläche eines adsorbierenden Feststoffs zurückgehalten wird.
- Adsorbentien: Es ist die feste Substanz, die die Retention anderer Substanzen fördert.
DAS Desorption es ist der umgekehrte Prozess der Adsorption, dh es ist die Freisetzung von Adsorbat von der Oberfläche des Adsorptionsmittels.
Typen
Abhängig von der Natur der an dem Prozess beteiligten Kräfte kann die Adsorption von zwei Arten sein: Physisorption und Chemisorption.
In einigen Fällen können beide Arten der Adsorption im gleichen Prozess auftreten.
Physisorption
Die physikalische Physisorption oder Adsorption zwischen dem Adsorbat und dem Adsorbens erfolgt durch Van-der-Waalls-Kräfte (Dipol-Dipol oder induzierter Dipol).
In diesem Fall findet keine molekulare Veränderung der am Prozess beteiligten Stoffe statt. Das heißt, die Substanz behält ihre chemische Natur.
Die physikalische Adsorption ist ein reversibler Prozess.
Chemisorption
Chemisorption oder chemische Adsorption besteht aus a chemische Reaktion. Durch die Einbeziehung der Elektronen, gilt als stärkere chemische Bindung als Physisorption.
Bei der Chemisorption kommt es zu einer molekularen Veränderung der am Prozess beteiligten Stoffe. Das heißt, die Substanz kann in eine andere umgewandelt werden.
Da es sich um eine chemische Reaktion handelt, müssen die Komponenten des Adsorbens und des Adsorbats Spezifität aufweisen. Sie müssen erkennen und reagieren können.
Die chemische Adsorption ist ein irreversibler Prozess.
Lesen Sie auch über:
- Intermolekularen Kräfte
- Chemische Bindungen
Adsorption und Absorption
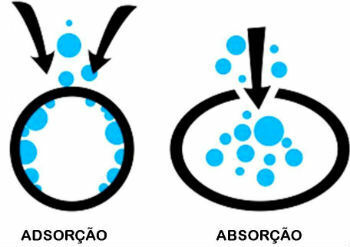
Unterschied zwischen Adsorption und Absorption
Adsorption und Absorption sind zwei verschiedene Prozesse. Kennen Sie den Unterschied zwischen ihnen:
- Adsorption: Ein Stoff wird jedoch auf der Oberfläche eines anderen zurückgehalten, ohne Teil seines Volumens zu sein.
- Absorption: Eine Substanz wird von einer anderen aufgenommen, wodurch sich das Volumen ändert.
Ein gängiges Beispiel für die Absorption ist der Schwamm, der Wasser aufnimmt. Dadurch wird das Wasservolumen in das Volumen des Schwamms eingearbeitet.
Aktivkohle
Aktivkohle ist ein Beispiel für eine besser bekannte Adsorptionssubstanz. In seiner Struktur befinden sich zahlreiche Poren, die die Rückhaltung von Stoffen intensivieren und deren Aufnahmefähigkeit erhöhen.
Daher wird Aktivkohle verwendet, um organische Substanzen, Öle, Farben und Gerüche zu entfernen. Es wird auch zur Wasseraufbereitung und zur Herstellung von Kosmetika und Arzneimitteln verwendet.

Aktivkohle
Lesen Sie auch:
- Chromatographie
- Trennung von Gemischen
- Gelöste und Lösungsmittel
- Materialien, die im Chemielabor verwendet werden