Einige Verbindungen haben in ihrer Struktur Doppelbindungen, die sich mit Einfachbindungen abwechseln. Das berühmteste von allen ist Benzol, dessen Struktur 1865 vom deutschen Chemiker Friedrich August Kekulé (1829-1896) vorgeschlagen wurde. Seine Struktur wäre zyklisch und besteht aus drei Doppelbindungen, die mit drei Einfachbindungen durchsetzt sind, wie in den folgenden Abbildungen gezeigt:
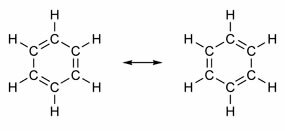
Beide Darstellungsweisen von Benzol sind akzeptabel, da es möglich ist, die Elektronen in den π-Bindungen zu ändern, ohne die Position der Atome zu ändern. Stellt jedoch weder genau das dar, was er ist, noch erklärt er sein Verhalten. Es sollte sich wie ein Alken verhalten und Additionsreaktionen provozieren, was in der Praxis jedoch nicht passiert. Benzol ist ziemlich stabil und verhält sich, als ob es keine Doppelbindungen hätte; es führt zu Substitutionsreaktionen wie bei Alkanen.
1930 schlug der amerikanische Wissenschaftler Linus Pauling die Resonanztheorie vor, die diesen scheinbaren Widerspruch erklärte. Diese Theorie sagte:
„Immer wenn wir in einer Strukturformel die Position der Elektronen ändern können ohne die Position der Atome zu verändern, die wahre Struktur Nein wird keine der erhaltenen Strukturen sein, sondern a Resonanzhybrid dieser Strukturen.“
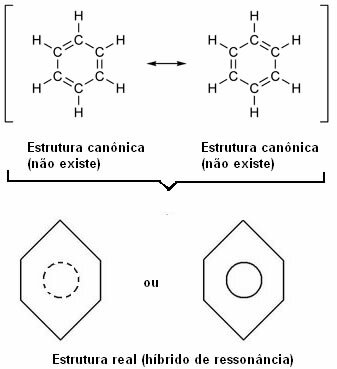
Dieser Effekt wird durch die Größe der Kohlenstoffbindungen und den Abstand zwischen ihnen belegt. Dieser Abstand liegt zwischen dem der Einfachbindung (1.54 ) und dem der Doppelbindung (1.34 ); aufgrund des Resonanzeffekts daher 1,39 beträgt.
Dieser Effekt ist auch in der Struktur des Ozonmoleküls (O3), Wie nachfolgend dargestellt:
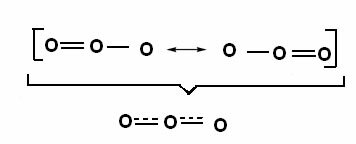
Kanonische Strukturen und Ozonresonanzhybride.
Von Jennifer Fogaça
Abschluss in Chemie
Schulteam Brasilien.
Quelle: Brasilien Schule - https://brasilescola.uol.com.br/quimica/ressonancia-compostosquimicos.htm


