Kovalente Bindung ist eine Art der Wechselwirkung zwischen Atomen mit hohem Elektronegativitätd.h. hohe Tendenz zur Aufnahme von Elektronen. Die chemischen Elemente, die üblicherweise an dieser Art von Bindung beteiligt sind, sind:
Wasserstoff (H)
Beryllium (Be)
Bor (B)
Kohlenstoff (C)
Stickstoff (N)
Phosphor (P)
Sauerstoff (O)
Schwefel (S)
Fluor (F)
Chlor (Cl)
Brom (Br)
Jod (ich)
a) Art der beteiligten Elemente
Die chemischen Elemente, die eine hohe Elektronegativität aufweisen und folglich kovalente Bindungen eingehen, sind:
Wasserstoff
Ametalle
b) Auftreten der kovalenten Bindung
Je nach Art der an der kovalenten Bindung beteiligten chemischen Elemente kann sie wie folgt ablaufen:
Zwischen zwei Wasserstoffatomen;
Zwischen einem Nichtmetallatom und Wasserstoff;
Zwischen Atomen desselben chemischen Elements (Nichtmetall);
Zwischen Atomen verschiedener chemischer Elemente (beides Nichtmetalle).
c) Anzahl der Elektronen, die jedes Atom erhalten muss
Die Anzahl der Elektronen, die jedes Nichtmetall- oder Wasserstoffatom in einer Bindung erhält, hängt von der Oktettregel.
Nach der Oktettregel ist ein Atom stabil, wenn es acht oder zwei Elektronen (nur bei Wasserstoff) in der Valenzschale aufnimmt. Wenn ein Atom beispielsweise fünf Elektronen in seiner Valenzschale hat, muss es drei Elektronen aufnehmen, um Stabilität zu erreichen.
HINWEIS: Beryllium und Bor sind Ausnahmen von der Oktettregel, da sie mit 4 bzw. 6 Elektronen in der Valenzschale stabil werden.
Die Anzahl der Elektronen in der Valenzschale lässt sich leicht durch Analyse der chemischen Elementfamilie bestimmen. In der folgenden Tabelle haben wir die Anzahl der Elektronen in der Valenzschale bezogen auf die Familie, zu der das Element gehört, und die Anzahl der Elektronen, die es aufnehmen muss, um Stabilität zu erreichen:

d) Kovalentes Bindungsprinzip
Wie bei der kovalenten Bindung haben alle beteiligten Atome die Tendenz, zwingend Elektronen aufzunehmen, zwischen ihnen wird eine gemeinsame Nutzung der Elektronen in der Valenzschale (der am weitesten vom Kern entfernten Ebene) bestehen.
Sharing tritt auf, wenn ein Elektron aus der Valenzschale eines Atoms Teil derselben Elektronenwolke wird, die ein anderes Elektron aus der Valenzschale eines anderen Atoms umgibt.
Jedes Wasserstoffatom hat beispielsweise ein Elektron in der Valenzschale. Wenn zwei Elektronen Teil derselben Wolke werden, beginnt jeder Wasserstoff, zwei Valenzelektronen zu haben, dh er stabilisiert sich.
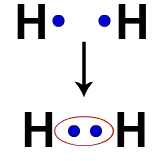
Elektronen von zwei Wasserstoffatomen, die dieselbe Elektronenwolke besetzen
e) Formeln für kovalente Bindungen
1ª) Molekularformel
Es ist die Angabe der Anzahl der Atome jedes Elements, die das Molekül bilden, das aus kovalenten Bindungen stammt.
Beispiel: H2Ö
Im Wassermolekül haben wir 2 Wasserstoffatome und 1 Sauerstoffatom.
2ª) Strukturformel
Die Strukturformel ist der Nachweis der Organisation des Moleküls, dh sie zeigt die Bindungen zwischen den Atomen. Dazu werden Bindestriche verwendet, die die Bindung jedes Atoms darstellen:
Einfach (?): Zeigt an, dass das Atom nur ein Elektron aus seiner Valenzschale mit einem anderen Atom geteilt hat und umgekehrt;
Doppelt (?): Zeigt an, dass das Atom zwei Elektronen aus seiner Valenzschale mit dem anderen Atom geteilt hat und umgekehrt;
Triple (≡): Zeigt an, dass das Atom drei Elektronen aus seiner Valenzschale mit einem anderen Atom geteilt hat und umgekehrt.
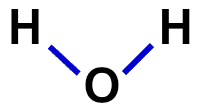
Strukturformel von Wasser
3ª) Lewis' elektronische Formel
Die elektronische Lewis-Formel stellt auch die Organisation des Moleküls (elektronische Formel) dar, zielt jedoch darauf ab, die Aufteilung von Elektronen in Atomen zu demonstrieren.
Um es aufzubauen, genügt es, die in einer Strukturformel vorgeschlagene Organisation zu respektieren und jede Spur der Bindungen (einfach, doppelt oder dreifach) durch „zwei Kugeln“ zu ersetzen, die die Elektronen darstellen.
In der Strukturformel von Wasser haben wir beispielsweise zwei einfache Bindungen zwischen Wasserstoff und Sauerstoff. Somit haben wir zwischen ihnen nur zwei Kugeln, die durch eine Ellipse (die die elektronische Wolke darstellt) begrenzt sind.
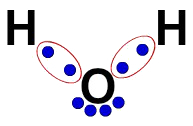
Lewis' elektronische Wasserformel
Von mir. Diogo Lopes Dias
Quelle: Brasilien Schule - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-ligacao-covalente.htm



