Isomerie Es ist ein natürliches Phänomen, bei dem verschiedene Stoffe (in Bezug auf chemische und physikalische Eigenschaften) genau die gleiche Summenformel haben, wie im folgenden Beispiel:
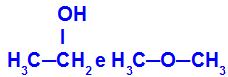
Verschiedene Substanzen mit der gleichen Summenformel
Ethanol (links) hat die Summenformel C2H6O, das auch mit Methoxyethan vorkommt (rechts), sind also Isomere.
Arten von Isomerie
→ flaches Isomer
Es ist die Art der Isomerie, die die strukturellen Unterschiede zwischen Isomeren untersucht.
Das) Besetzung
Es ist die Art der flachen Isomerie, bei der der Unterschied zwischen den Substanzen auf dem Unterschied zwischen den organischen Funktionen beruht, zu denen sie gehören. Sehen Sie einige Beispiele:
Propanon und Propan:
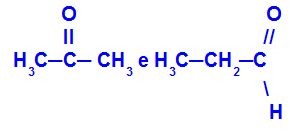
Isomere mit unterschiedlichen Funktionen
Propanon (links) gehört zur Ketongruppe, Propanal (rechts) zur Aldehydgruppe.
B) Gefängnis
Es ist die Art der flachen Isomerie, bei der der Unterschied zwischen Substanzen auf dem Unterschied zwischen den vorhandenen Ketten beruht. Siehe ein Beispiel:
2-Methylpropan und Butan
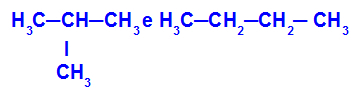
Isomere mit Ketten unterschiedlicher Klassifikation
Im Beispiel sehen wir, dass 2-Methylpropan (links) eine verzweigte Kette hat und Butan (rechts) eine normale Kette hat.
ç) Position
Es ist die Art der flachen Isomerie, bei der der Unterschied zwischen Substanzen auf der unterschiedlichen Position einer in ihren Ketten vorhandenen Komponente beruht. Siehe ein Beispiel:
1-Chlor-propan und 2-Chlor-propan
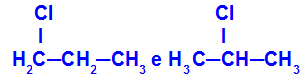
Isomere mit Komponenten an unterschiedlichen Positionen in der Kette
Im Beispiel können wir sehen, dass bei 1-Chlorpropan (links) das Chlor an Kohlenstoff 1 positioniert ist und bei 2-Chlorpropan (rechts) das Chlor an Kohlenstoff 2 positioniert ist.
d) Metamerie oder Kompensation
HINWEIS: Isomerie gilt ausschließlich für heterogene Strings.
Es ist die Art der flachen Isomerie, bei der der Unterschied zwischen den Substanzen auf der unterschiedlichen Position eines in ihren Ketten vorhandenen Heteroatoms beruht. Siehe ein Beispiel:
Beispiel: Methoxypropan und Ethoxyethan
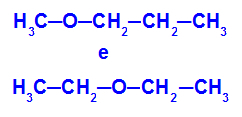
Isomere mit Heteroatomen an verschiedenen Positionen in der Kette
Im Beispiel sehen wir, dass Sauerstoff in Methoxypropan (links) ein Radikal mit einem Kohlenstoff auf der einen und drei Kohlenstoffen auf der anderen Seite hat. In Ethoxyethan (rechts) hat Sauerstoff ein Radikal mit zwei Kohlenstoffen auf der einen und zwei Kohlenstoffen auf der anderen.
und)Autonomie
Es ist ein Sonderfall der Isomerie der ebenen Funktion und tritt nur in drei organischen Funktionen auf:
Aldehyd
Keton
Enol
Diese Art der Isomerie beruht darauf, dass zwischen einem Enol und einem Aldehyd sowie zwischen einem Enol und einem Keton ein chemisches Gleichgewicht besteht, dh diese Komponenten wandeln sich ständig ineinander um. Siehe ein Beispiel:
Prop-2-en-1-ol und Propanon
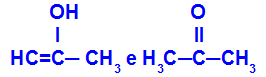
Isomere mit unterschiedlichen Funktionen
Im Beispiel sehen wir, dass Prop-2-en-1-ol (links) zur Gruppe der Enole und Propanon (rechts) zur Gruppe der Ketone gehört, also Isomere der Tautomerie sind.
→ Weltraumisomerie
Es ist eine Art von Isomerie, die durch die räumliche Analyse des Moleküls definiert wird.
a) Geometrische Isomere
Hör jetzt nicht auf... Nach der Werbung kommt noch mehr ;)
Es ist eine Art von räumlicher Isomerie, die auftritt, wenn der Stoff Moleküle mit den folgenden Eigenschaften aufweist:
Geschlossene Kette mit zwei Kohlenstoffatomen mit zwei verschiedenen Liganden, wie im folgenden Beispiel:

Geschlossene Struktur mit geometrischer Isomerie
Offene Kette mit einer Doppelbindung zwischen den Kohlenstoffen und in jedem dieser Kohlenstoffe der Doppelbindung befinden sich zwei verschiedene Liganden, wie im folgenden Beispiel:
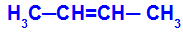
Offene Struktur mit geometrischer Isomerie
Die geometrische Isomerie wird in zwei Gruppen unterteilt:
1Ö Gruppe: cis-trans
Es tritt auf, wenn die beiden Liganden eines Kohlenstoffs den beiden Liganden des anderen Kohlenstoffs strikt gleich sind, sei es in der offenen Struktur oder in der geschlossenen Struktur.
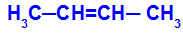
Kette einer Substanz mit cis-trans-Isomerie
Das Isomer wird cis genannt, wenn sich dieselben Liganden in derselben Ebene befinden.

Beispiel für ein cis-Isomer
Das Isomer wird trans genannt, wenn die verschiedenen Liganden in derselben Ebene liegen.

Beispiel für ein trans-Isomer
2Ö Gruppe: E-Z
Sie tritt auf, wenn sich die beiden Liganden eines Kohlenstoffs in Bezug auf die beiden Liganden des anderen Kohlenstoffs entweder in der offenen Struktur oder in der geschlossenen Struktur unterscheiden.

Kette einer Substanz mit E-Z-Isomerie
Das Isomer wird E genannt, wenn die Liganden mit der höchsten Ordnungszahl in entgegengesetzten Ebenen liegen. Im Beispiel unten hat der Kohlenstoff links das Br mit der höchsten Ordnungszahl (35) und der andere Sauerstoff (8).
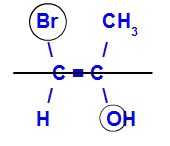
Beispiel für ein E-Isomer
Das Isomer wird Z genannt, wenn die Liganden mit der höchsten Ordnungszahl in derselben Ebene liegen. Im Beispiel unten hat der Kohlenstoff links das Br mit der höchsten Ordnungszahl (35) und der andere Sauerstoff (8).

Beispiel für ein Z-Isomer
B) optisches Isomer
Es handelt sich um eine Art räumliche Isomerie, die nur auftritt, wenn der Stoff Moleküle mit chiraler Kohlenstoff (der mit vier verschiedenen Liganden) in ihren Strukturen. Das Molekül mit chiralem Kohlenstoff hat die Fähigkeit, Licht wie folgt zu polarisieren und abzulenken:
Nach rechts (rechtshändiges Isomer)
Links (linksdrehendes Isomer)
Eine Verbindung mit optischer Aktivität hat immer aktive Isomere (sogenannte optische Antipoden) und inaktive Isomere (Gemisch zwischen zwei aktiven Isomeren, ein Gemisch namens racemisch).
Wir können die folgende Formel verwenden, um die Anzahl der aktiven (IOA) und inaktiven (IOI) Isomere einer Verbindung mit chiralem Kohlenstoff zu bestimmen:
IOA = 2Nein
IOI = 2Nein
2
Unten ist ein Beispiel für eine Verbindung mit geometrischer Isomerie:
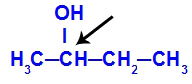
Chiraler Kohlenstoff in Butan-2-ol
Die Struktur von Butan-2-ol hat die folgenden Liganden:
Methyl (CH3)
Ethyl (CH3-CH2)
Wasserstoff (H)
Hydroxyl (OH)
Da es nur einen chiralen Kohlenstoff hat, hat Butan-2-ol daher:
Aktive Isomere:
IOA = 21
IOA = 2
Inaktive Isomere:
IOI = 21
2
IOI = 2
2
IOI = 1
Von mir. Diogo Lopes Dias
Möchten Sie in einer schulischen oder wissenschaftlichen Arbeit auf diesen Text verweisen? Aussehen:
TAGE, Diogo Lopes. "Was ist Isomerie?"; Brasilien Schule. Verfügbar in: https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-isomeria.htm. Zugriff am 27. Juni 2021.

