definiert sich als Hybridisierung die Vereinigung unvollständiger Atomorbitale. Ein Orbital wird als unvollständig klassifiziert, wenn es nur eines hat Elektron darin statt zwei. Sehen Sie sich eine Darstellung eines unvollständigen Orbitals und eines vollständigen Orbitals an:

In Bild A haben wir ein vollständiges Orbital; in Bild B ein unvollständiges Orbital.
Hybridisierung ist ein natürliches Phänomen, das bei einigen chemischen Elementen wie Phosphor, Schwefel, Kohlenstoff usw. auftritt. Die Hybridisierung von Kohlenstoff ermöglicht es den Atomen dieses Elements, vier chemische Bindungen einzugehen, dh Kohlenstoff geht nur vier Bindungen ein, nachdem er das Phänomen der Hybridisierung durchlaufen hat.
Aber warum hybridisiert Kohlenstoff und geht vier Bindungen ein? Um dieses Phänomen zu verstehen, müssen wir die elektronische Verteilung dieses Elements kennen:
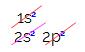
In der Elektronenverteilung von Kohlenstoff sehen wir, dass das 1s-Unterniveau vollständig ist (mit zwei Elektronen), das 2s ist vollständig (mit zwei Elektronen) und das 2p-Unterniveau ist unvollständig (das p-Unterniveau unterstützt sechs Elektronen, aber es gibt nur zwei). Um die 2p-Elektronen repräsentativ zu verteilen, müssen wir:
Hör jetzt nicht auf... Nach der Werbung kommt noch mehr ;)
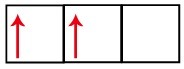
Die Unterebene p hat drei Orbitale – bei Kohlenstoff sind zwei davon unvollständig und eines leer. Aus diesem Grund sollte dieses Element nur zwei Links ausführen, da die Anzahl der unvollständigen Orbitale immer die Anzahl der Links bestimmt.
Wenn jedoch Energie aus der äußeren Umgebung aufgenommen wird, werden die im Kohlenstoff vorhandenen Elektronen angeregt. Somit bewegt sich eines der Elektronen der Unterebene 2s auf das leere Orbital der Unterebene p:
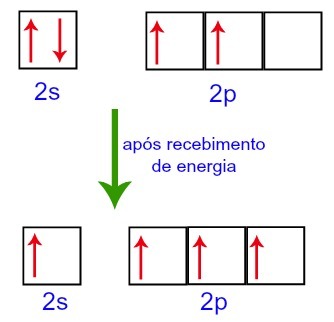
Kohlenstofforbitale vor und nach dem Empfang von Energie aus der äußeren Umgebung
Somit verbleibt Kohlenstoff mit vier unvollständigen Orbitalen in seiner zweiten Ebene. Dann verbindet sich das 2s-Sublevel-Orbital mit den drei p-Orbitalen, was das Phänomen von. konfiguriert Hybridisierung.
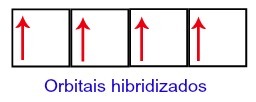
Kohlenstofforbitale nach Hybridisierung
Von mir. Diogo Lopes Dias
Möchten Sie in einer schulischen oder wissenschaftlichen Arbeit auf diesen Text verweisen? Aussehen:
TAGE, Diogo Lopes. "Hybridisierung von Kohlenstoff"; Brasilien Schule. Verfügbar in: https://brasilescola.uol.com.br/quimica/hibridizacao-carbono.htm. Zugriff am 28. Juni 2021.


