Sie Kohlenwasserstoffe bestehen aus Kohlenstoff (C) und Wasserstoff (H). Die Flexibilität von Kohlenstoff, dem Hauptelement dieser Verbindungen, begünstigt die Existenz einer großen Vielfalt von Strukturen Daher können sich einige Eigenschaften, wie Schmelzpunkt und Siedepunkt, zwischen einem Kohlenwasserstoff unterscheiden.
Sie sind meist Moleküle apolar, mit Stärkeso intermolekular induzierter Dipoltyp und Dichte kleiner als Das aus Wasser. Die Identifizierung dieser Verbindungen kann durch die Nomenklatur erfolgen, die den Regeln der International Union of Pure and Applied Chemistry (Iupac) folgt.
Lesen Sie auch: Kohlenstoff - eines der am häufigsten vorkommenden Elemente im Universum
Eigenschaften von Kohlenwasserstoffen

Polarität: Kohlenwasserstoffe ohne das Vorhandensein von Heteroatomen sind apolar.
Intermolekularen Kräfte: die Bindungen zwischen den Molekülen eines Kohlenwasserstoffs sind vom Typ induzierten Dipol.
Schmelzpunkt und undSieden: sie variieren je nach Größe, Funktion und struktureller Organisation des Moleküls.
Körperlicher Status: Unter normalen Temperatur- und Druckbedingungen befinden sich Kohlenwasserstoffe mit vier oder weniger Kohlenstoffatomen in einem gasförmigen Zustand. Solche mit 5 bis 17 Kohlenstoffen sind in flüssigem Zustand, und Kohlenwasserstoffe mit mehr als 17 Kohlenstoffen sind feste Stoffe.
Dichte: ist kleiner als die Dichte Wasser, dh weniger als 1,0 g/cm³.
Reaktivität: aliphatische und ungesättigte Kohlenwasserstoffe sind wenig reaktiv; ungesättigte Verbindungen reagieren eher mit anderen Molekülen und zyklische Kohlenwasserstoffe mit bis zu fünf Kohlenstoffatomen sind sehr reaktiv.
Klassifizierung von Kohlenwasserstoffen
Die Kohlenwasserstoffe kann durch die strukturelle Organisation der Kette klassifiziert werden und von den Betrieben.Ungesättigtheit ist das Vorhandensein von Doppel- oder Dreifachbindungen zwischen Kohlenstoffen, ist das Auftreten von Anschlüsse vom Typ pi (π). schon die Geäst sie sind wie „Zweige“, die an eine größere Kohlenwasserstoffstruktur gebunden sind. Zyklische Ketten können auch Verzweigungen und/oder Ungesättigtheiten enthalten – die strukturelle Organisation von geschlossenkettigen Kohlenwasserstoffen bildet Polygone wie unter anderem Quadrat, Dreieck, Hexan.
Hinsichtlich der Anordnung der Atome kann ein Kohlenwasserstoff eine normale oder verzweigte Kette aufweisen.
→ C-Kohlenwasserstoffnormale, lineare oder gerade Linie: die mit einer Schnur, die nur zwei Enden hat.

→ C-Kohlenwasserstoffhasst verzweigt: der mit einer Kette, die mehr als zwei Enden hat. Um zu wissen, wo und was die Filialen sind, ist es wichtig, die Hauptkette richtig auszuwählen. Die Hauptkette muss alle Ungesättigtheiten und Heteroatome (falls vorhanden) enthalten, ebenso gut wie die größte Anzahl aufeinanderfolgender Kohlenstoffe. Kohlenstoffe, die nicht in der Hauptkette enthalten sind, sind Verzweigungen.
Beispiel:

Ein Kohlenwasserstoff kann hinsichtlich seines "Verschlusses" eine geschlossene, offene oder gemischte Kette aufweisen.
→ Kettenkohlenwasserstoffeso geschlossen oder zyklisch: solche mit Ketten, in denen sich die Atome zu einem Zyklus, einem Polygon oder einem aromatischen Ring organisieren (geschlossener Kohlenwasserstoff mit alternierenden Ungesättigtheiten). Keine losen Enden haben, es sei denn, es gibt einen Zweig. Jeder Scheitelpunkt des Polygons repräsentiert einen Kohlenstoff und seine jeweiligen Wasserstoffbindungsmittel.
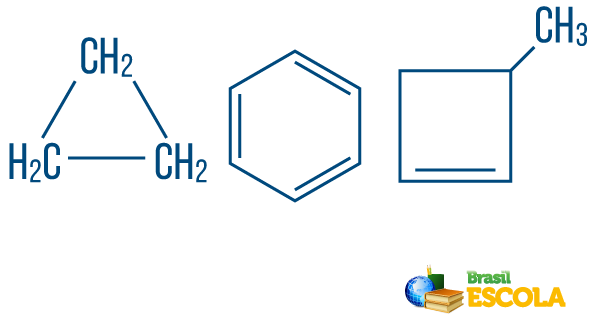
→ Offenkettige oder azyklische Kohlenwasserstoffe: sind solche mit Ketten, die mindestens zwei Enden haben.

→ Kohlenwasserstoff von gemischte Zeichenfolge: durch einen Ring oder eine cyclische Kette gebildet wird, die an einem linearen Teil befestigt ist; es hat mindestens ein Ende.
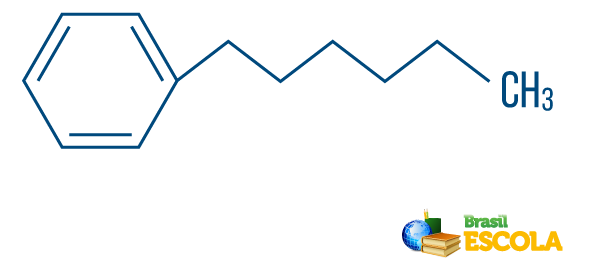
Lesen Sie auch: Aromatische Kohlenwasserstoffe - Beispiele und Eigenschaften
Nomenklatur der Kohlenwasserstoffe
Für jede Art von Kohlenwasserstoff gibt es eine von Iupac aufgestellte Namensregel. Die Nomenklatur dieser Verbindungen erfolgt wie folgt:
1. Teil: Standort und Name der Filiale(n) (falls vorhanden);
2. Teil: der Begriff gilt Zyklus wenn es sich bei der Verbindung um eine geschlossene Kette, aber um eine aliphatische (offene) Kette handelt, ist dies nicht erforderlich;
3. Teil: Präfix, das angibt, wie viele Kohlenstoffe sich in der Hauptkette befinden;
4. Teil: Ort und Infix, die die Art der Ungesättigtheit im Molekül anzeigen;
5. Teil: Suffix „o“ für Kohlenwasserstoffe.
Wenn das Molekül eine offene Struktur ohne Verzweigung hat, beginnt die Nomenklatur in Teil 3.
Die folgende Tabelle zeigt die erforderlichen Informationen (Präfix, Infix und Suffix) für die Kohlenwasserstoff-Nomenklatur im Allgemeinen. Ö Präfix variiert mit der Anzahl der Kohlenstoffe; Ö Infix, nach der Anzahl der Ungesättigtheiten; es ist das Suffix“Ö" bezieht sich auf Verbindungen vom Kohlenwasserstofftyp.
Präfix |
Infix |
Suffix |
||
1 Kohlenstoff |
getroffen- |
Nur Einzelanrufe |
-ein- |
-Ö |
2 Kohlen |
et- |
|||
3 Kohlen |
Stütze- |
1 Doppelbindung |
-de- |
|
4 Kohlen |
aber- |
|||
5 Kohlen |
eingepfercht- |
2 Doppelbindungen |
-dien- |
|
6 Kohlen |
verhexen- |
|||
7 Kohlen |
hept- |
1 Dreifachbindung |
-im- |
|
8 Kohlen |
Okt- |
|||
9 Kohlen |
nicht- |
2 Dreifach-Links |
-diin- |
|
10 Kohlen |
Dez- |
Der erste Schritt zur Entdeckung der Nomenklatur einer organischen Verbindung ist identifiziere die Hauptkette von Kohlenstoffen, die die Ungesättigtheiten und so viele aufeinanderfolgende Kohlenstoffe wie möglich enthalten müssen. Nachdem die Hauptkette identifiziert wurde, Kohlenstoffe müssen aufgezählt werden – Beginnen Sie mit der Zählung von der Seite, die den Ästen und Ungesättigten (falls vorhanden) am nächsten liegt. DAS Lokalisierung wird die Nummer des Kohlenstoffs sein, an dem die Verzweigung oder Ungesättigtheit gefunden wird. Manchmal gibt es nur eine mögliche Position für ein Radikal oder eine Doppel- oder Dreifachbindung, so dass es nicht notwendig ist, die Position des verbindenden Kohlenstoffs in der Nomenklatur anzugeben.

DAS Nomenklatur für Zweige wird durch die Anzahl der Kohlenstoffe in jedem gegeben, plus Terminierung Linie oder ll. Bei mehreren Filialen wird die alphabetische Reihenfolge verwendet.
Siehe die folgenden Beispiele:
→ Beispiel 1
CH3 - CH2 - CH3 → Propan
1. Teil: das Präfix „Stütze-“ zeigt an, dass die Kette drei Kohlenstoffe hat.
2. Teil: das Infix "-ein-” signalisiert, dass das Molekül nur Verbindungen des Typs makes sigma oder einfach.
3. Teil: das Suffix "-Ö“ ist charakteristisch für Kohlenwasserstoffe.
→ Beispiel 2
CH2=CH-CH2-CH3 → But-1-en
Bei Kohlenwasserstoffen mit Ungesättigtheit ist es notwendig, den Kohlenstoff, in dem sich das Paar befindet, zu nummerieren und zu lokalisieren, und die Nummerierung muss so klein wie möglich sein. Dazu muss die Kohlenstoffzahl mit der Seite beginnen, die der Doppelbindung am nächsten ist.
1. Teil: "aber-" zeigt an, dass es vier Kohlenstoffe in der Kette gibt.
2. Teil: "1-de" bezieht sich auf eine Ungesättigtheit zwischen Kohlenstoff 1 und 2.
3. Teil: "-Ö" ist das charakteristische Suffix von Kohlenwasserstoffen.
→ Beispiel 3

1. Teil: "3-ethyl" signalisiert, dass es an Kohlenstoff 2 einen Zwei-Kohlenstoff-Zweig gibt.
2. Teil: "-gepachtet-" zeigt das Vorhandensein von fünf Kohlenstoffatomen in der Hauptkette an.
3. Teil: "-ein-" ist das Infix, das auf ungesättigte Ketten angewendet wird (keine Doppel- oder Dreifachbindungen).
4. Teil: "-Ö" ist das charakteristische Suffix von Kohlenwasserstoffen.
→ Beispiel 4
Für Ketten mit mehr als eine Filiale, ordne die Reste der Nomenklatur in alphabetischer Reihenfolge. Bei Verzweigungen und Ungesättigtheiten im selben Molekül sollte die Zählung der Kohlenstoffe in der Hauptkette so erfolgen, dass die Summe der Ortszahlen möglichst klein ist.
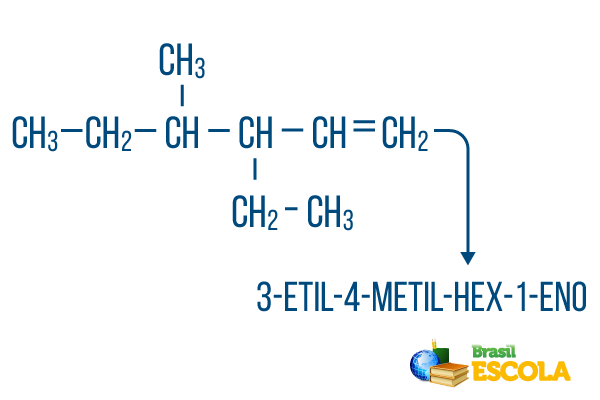
Die Kohlenstoffzählung der Hauptkette wurde von links nach rechts durchgeführt, und die Summe der Ungesättigtheits- und Verzweigungsstellenzahlen ist: 1+4+3 = 8. Wäre die Kohlenstoffzahl von rechts nach links gewesen, wäre die zusammengesetzte Nomenklatur 4-Ethyl-3-methyl-5-en, deren Summe der Orte wäre: 4+3+5 = 12, was größer ist als die andere Hypothese, daher sollte sie nicht verwendet werden.
1. Teil: 3-Ethyl-4-methyl verweist auf die Radikale in alphabetischer Reihenfolge und ihre jeweilige Position.
2. Teil: verhexen- bedeutet, dass die Hauptkette 6 Kohlenstoffe enthält.
3. Teil: 1-de zeigt das Vorhandensein einer Doppelbindung an Kohlenstoff 1 an.
4. Teil: "-Ö" ist das charakteristische Suffix von Kohlenwasserstoffen.
→ Beispiel 5
Für geschlossene Strings gelten die Namensregeln, aber das Wort Zyklus beginnt den Namen der Verbindung und weist darauf hin, dass es sich um einen geschlossenen oder zyklischen Kohlenwasserstoff handelt.
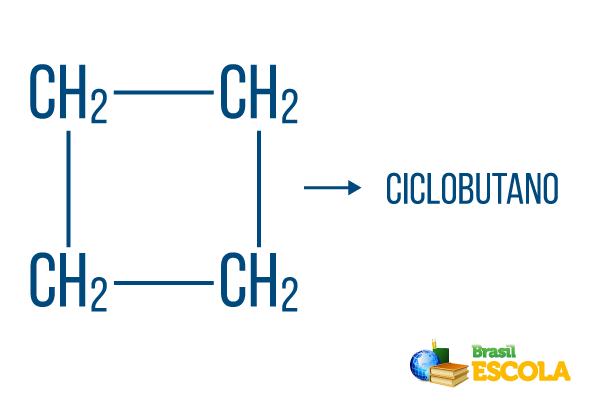
1. Teil: Zyklus- gibt an, dass es sich um eine geschlossene Zeichenfolge handelt.
2. Teil: -aber- bezeichnet die Existenz von 4 Kohlenstoffatomen in der Kette
3. Teil: -Öist das charakteristische Suffix von Kohlenwasserstoffen.
Lesen Sie auch: Klassifizierung von Kohlenstoffketten
Arten von Kohlenwasserstoffen
Kohlenwasserstoffe können in Alkane, Alkene, Alkine und Alkadiene unterteilt werden - die klassifiziert werden als je nach Aufbau der Kette (Doppel- oder Dreifachbindungen) - und Cyclane, das sind die Ketten geschlossen.
→ Alkane: sind Kohlenwasserstoffe, die keine Ungesättigtheit aufweisen. Die allgemeine Formel für Alkane ist CNeinH2n+2, und der NeinOmenklatur es ist komponiert von Präfix + ein + Ö.
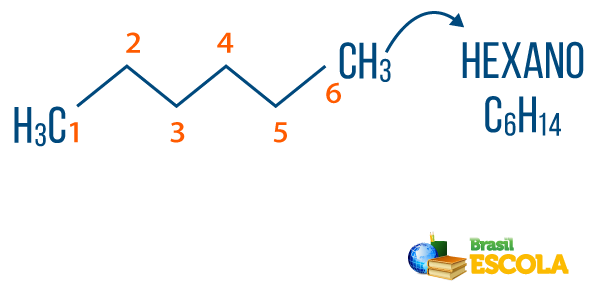
Sie alkane findet man in der Natur, wie gas Methan (CH4), das von Tieren freigesetzt und bei Zersetzungsprozessen sowie in Raffinerien und in der petrochemischen Industrie produziert wird. Verbindungen wie Propan (Ç3H7), Butan (Ç4H10), aus dem unser Kochgas (LPG) besteht, und die Oktan (Ç8H18), die in Kraftstoffen für Kraftfahrzeuge enthalten sind, sind Nebenprodukte von Petroleum.

→ Alkene oder Alkene: sind Kohlenstoffketten, die eine Ungesättigtheit haben, eine Doppelbindung. Seine allgemeine Formel ist CNeinH2n, und Ihre NeinOmenklatur es ist komponiert von Prefix + de + o.

Ö Ethylengas (Ç2H4), die in der Landwirtschaft verwendet wird, um die Reifung von Früchten zu beschleunigen, gehört zur Funktion Alken. Die Verbindung wird auch bei der Herstellung von Rohstoffen verwendet Polyethylen, zur Herstellung von Kunststoffgeschirr verwendet.
→ Alkine oder acetylenisch: Kohlenwasserstoffe mit Dreifachbindung. Seine allgemeine Formel ist CNeinH2n - 2. DAS Nomenklatur es ist komponiert von Präfix + in + o.

Ö Acetylen oder etine (C2H2) ist ein Gas der Alkinfunktion in Schweißnähte und Metallschnitte. Diese Masse kann Temperaturen von bis zu 3.000 °C erreichen und ermöglicht so Reparaturen an unter Wasser liegenden Schiffsteilen.

→ Alkadiene oder Diene: Kohlenstoffketten mit zwei Ungesättigtheiten, d. h. zwei Doppelbindungen zwischen den Kohlenstoffen. Die allgemeine Formel für diese Funktion ist C.NeinH2n - 2. Erkenne, dass es die gleiche Formel wie bei Alkinen ist, was bedeutet, dass es passieren kann Isomerie zwischen Verbindungen (gleiche Summenformel für verschiedene Verbindungen).
Die Nomenklatur eines Alkadiens setzt sich zusammen aus Prefix + dien + o.
Beispiel:

→ Geschlossene Kohlenwasserstoffe: die Moleküle organisieren sich zyklisch, neigen dazu, ein Vieleck zu bilden, und es können wie in offenen Ketten Etablierungen und/oder Verzweigungen auftreten. Cyclone, Cyclene, Cycline und Benzole sind geschlossenkettige Kohlenwasserstoffe.
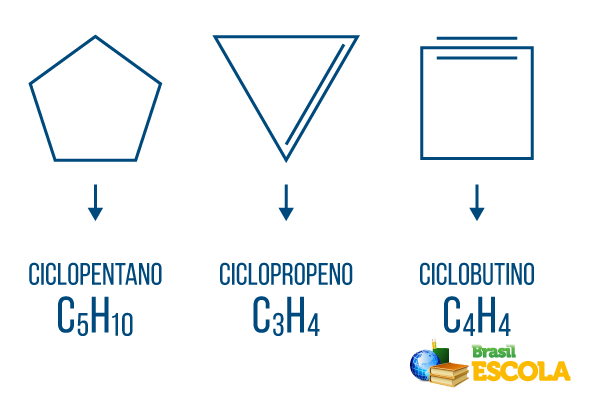
Zyklone oder Cycloalkane: cyclische Ketten, die nur aus Einfachbindungen bestehen. Seine allgemeine Formel ist CNeinH2n. Nomenklatur: ciclo + Präfix + ein + o.
Zyklen oder Cycloalkene: geschlossene Kohlenwasserstoffketten mit einer Einrichtung. Seine allgemeine Formel ist CNeinH2n-2. Nomenklatur: çiclo + Präfix + en + Ö.
-
Cycline oder Cycloalkine: geschlossenkettige Kohlenwasserstoffe mit zwei Doppelbindungen. Seine allgemeine Formel ist CNeinH2n-4. Nomenklatur: çiclo + Präfix + in + o.
Benzole
Benzol ist eine Art geschlossenkettiger Kohlenwasserstoff mit sechs Kohlenstoffe wobei die Bindungen zwischen einfach und doppelt variieren. Diese Verbindungen sind giftig und stark krebserregend, da sie als organische Lösungsmittel in chemischen Prozessen verwendet werden.
Damit der Kohlenwasserstoff als aromatisch angesehen wird, muss mindestens ein Kohlenwasserstoff vorhanden sein Benzolring, das hochreaktiv ist, daher zwei oder mehr Ersatz, die wir hier als Konsequenzen sehen werden. Wenn es zwei verbindende Radikale gibt, haben wir für jedes Positionspaar spezifische Namen.
Radials auf 1,2 Kohlenstoffen von Benzol → ortho
Radikale an den 1,3-Kohlenstoffatomen von Benzol → Tor
Radials auf Kohlenstoff1,4 von Benzol → zum
Die Annomenklatur einer aromatischen Verbindung erfolgt wie folgt:
1. Teil: Positionierung der Liganden (Ortho, Tor oder To).
2. Teil: Name des oder der an Benzol gebundenen Radikale (Methyl, Ethyl, Propyl…). Die Namensgebung von Radikalen folgt der Regel anderer Kohlenwasserstoffe.
- 3. Teil: -BGift, das ist der charakteristische Begriff für aromatische Kohlenwasserstoffe.
Beispiele:
→ Ortho-dimethyl-benzol

1. Teil: Örto- zeigt an, dass die Radikale an den Kohlenstoffatomen 1 und 2 positioniert sind.
2. Teil: -dimethyl- bezieht sich auf die beiden Reste, beide mit einem Kohlenstoff.
3. Teil: -Benzol ist der charakteristische Begriff für aromatische Kohlenwasserstoffe.
→ Ortho-ethyl-methyl-benzol
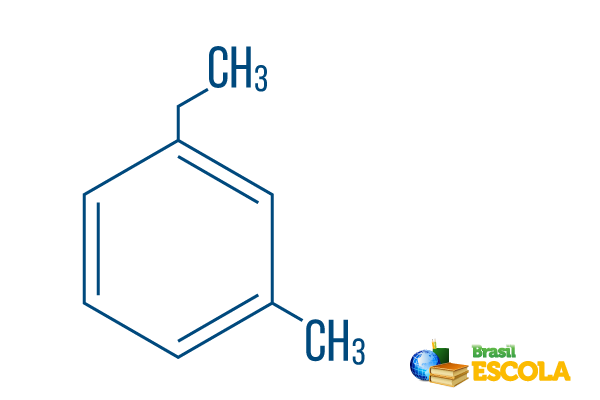
1. Teil: ichOh- zeigt an, dass die Radikale an den Kohlenstoffatomen 1 und 3 positioniert sind.
2. Teil: ethyl-methyl- bezieht sich auf die Menge an Kohlenstoff in jedem Radikal, wobei ethyl Das Zwei-Kohlenstoff-Zweig und Methyl Verzweigung mit einem Kohlenstoff - in alphabetischer Reihenfolge in die Nomenklatur eingeordnet.
3. Teil: -Benzol ist der charakteristische Begriff für aromatische Kohlenwasserstoffe.
→ Para-Diethyl-Benzol
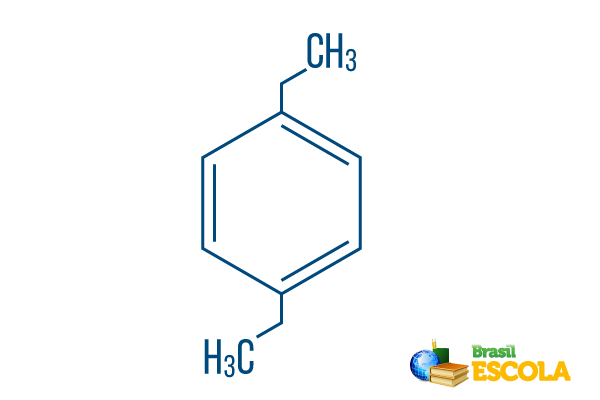
1. Teil: PPflug- zeigt an, dass sich die Radikale an den Kohlenstoffatomen 1 und 4 von Benzol befinden.
2. Teil: -diethyl- verweist auf zwei Radikale des Typs Äthyl, das heißt, zwei Zweige mit jeweils zwei Kohlenstoffen.
3. Teil: -Benzol ist der charakteristische Begriff für aromatische Kohlenwasserstoffe.
Lesen Sie auch:Entdeckung der Struktur von Benzol
Übungen gelöst
(Unesp) – Oktan ist einer der Hauptbestandteile von Benzin, einem Gemisch von Kohlenwasserstoffen. Die Summenformel von Oktan lautet:
a) C8H18
b) C8H16
c) C8H14
d) C12H24
e) C18H38
Antwort: Buchstabe a). Analyse der zusammengesetzten Nomenklatur Oktan, es ist ein Alkan, also ein Molekül, das nur aus Einfachbindungen besteht. Wenn die allgemeine Formel für Alkane C. istNeinH2n+2, „n“ durch acht ersetzen, das ist die Menge an Kohlenstoffen in der Hauptkette – und in diesem Fall einzigartig – haben wir die Summenformel von Octan C8H18.
(UFSCar-SP) – Beachten Sie die folgenden Aussagen zu Kohlenwasserstoffen.
I) Kohlenwasserstoffe sind organische Verbindungen, die nur aus Kohlenstoff und Wasserstoff bestehen.
II) Als Alkene werden nur geradkettige ungesättigte Kohlenwasserstoffe bezeichnet.
III) Cycloalkane sind gesättigte aliphatische Kohlenwasserstoffe mit der allgemeinen Formel CnH2n.
IV) Sind aromatische Kohlenwasserstoffe: Brombenzol, p-Nitrotoluol und Naphthalin.
Folgende Aussagen sind richtig:
a) Nur I und III.
b) nur I, III und IV.
c) Nur II und III.
d) nur III und IV.
e) nur I, II und IV.
Antwort: Buchstabe a).
II – Alkene sind Verbindungen mit einer Doppelbindung, also ungesättigt, können aber in ihrer Kette Verzweigungen haben, die nicht ausschließlich linear sind.
IV - Die Brometobenzol- und p-Nitrotoluol-Verbindungen gehören zu anderen organische Funktionen.
von Laysa Bernardes
Chemielehrer
Quelle: Brasilien Schule - https://brasilescola.uol.com.br/quimica/hidrocarbonetos.htm

