In Studien zu Phasenwechseln von Stoffen sehen wir, dass es möglich ist, diese Änderung durch Zufuhr oder Entnahme von Wärmeenergie herbeizuführen. Die einfachsten Beispiele für dieses Geschehen sind Zustandsänderungen von fest zu flüssig, von flüssig zu gasförmig oder umgekehrt. Wenn wir zum Beispiel ein Stück Eis erhitzen, das heißt, wenn wir ihm Wärme geben, werden wir sehen, dass es schmilzt (oder schmilzt).
Daher können wir das sagen Zustandsänderung es ist eine interne Reorganisation der Atome (oder Moleküle) einer Substanz, die erhebliche Veränderungen ihrer Eigenschaften verursacht.
Heiz- und Kühlkurven: was passiert während eines Phasenübergangs.
Aufheiz- oder Abkühlkurven zeigen die Temperaturänderung über die Zeit, wenn das Objekt Energie verliert oder gewinnt.
Betrachten wir eine Menge von 1 kg Eis mit einer Anfangstemperatur von -20°C (Punkt A in der Abbildung oben) und einer konstanten Heizrate von 1000 Watt, also 1000 J/s.
Bei Aufnahme dieser Energie beginnen die als Festkörper angeordneten Wassermoleküle jeweils zu schwingen schnell, was zu einem linearen Temperaturanstieg führt, der durch die Gleichung bestimmt wird: Q = m.c.Δt.
Hör jetzt nicht auf... Nach der Werbung kommt noch mehr ;)
Dies geschieht bis zu dem Moment, in dem das Eis die Temperatur von 0 °C erreicht, Punkt B in der Grafik, wenn die Schwingung der Moleküle so ist, dass die Bindungen zwischen ihnen zu brechen beginnen. An diesem Punkt beginnt das Eis zu schmelzen und die gesamte zugeführte Energie wird verwendet, um die Bindungen aufzubrechen, die die Struktur festhalten.
Aus diesem Grund bleibt die Temperatur konstant, bis das gesamte Eis geschmolzen ist, obwohl ständig Energie zugeführt wird. Die beim Übergang zugeführte Energie kann aus dem Ausdruck Q = m gewonnen werden. L.
Ab dem Moment, in dem das Eis vollständig geschmolzen ist (Punkt C), steigt die Wassertemperatur ständig an. Seine Moleküle schwingen schneller, bis sie die Siedetemperatur erreichen (Punkt D).
Die von diesem Moment an aufgenommene Wärme wird verwendet, um das Wasser zu verdampfen, das eine konstante Temperatur behält, bis die Flüssigkeit vollständig verdampft ist (Punkt E). Die gesamte Energie, die von diesem Punkt empfangen wird, wird verwendet, um den Dampf zu erhitzen.
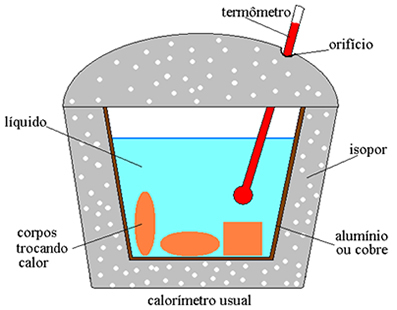
Die Konstruktion solcher Diagramme aus experimentellen Daten ermöglicht es, die Übergangstemperaturen und die Werte der spezifischen Wärme und der latenten Wärme genau zu bestimmen.
Von Domitiano Marques
Abschluss in Physik
Möchten Sie in einer schulischen oder wissenschaftlichen Arbeit auf diesen Text verweisen? Aussehen:
SILVA, Domitiano Correa Marques da. „Heiz- und Kühlkurven“; Brasilien Schule. Verfügbar in: https://brasilescola.uol.com.br/fisica/curvas-aquecimento-resfriamento.htm. Zugriff am 27. Juni 2021.