Wie im Text "Alpha-Emission (α)“ führte der neuseeländische Chemiker Ernest Rutherford ein Experiment durch, bei dem er eine Probe eines radioaktiven Materials in einen Bleiblock mit einem Loch platzierte, um die radioaktiven Emissionen zu lenken; und setzte diese Strahlungen einem elektromagnetischen Feld aus.
Unter den erhaltenen Ergebnissen bemerkte Rutherford, dass ein Strahlungsstrahl von der positiven Platte angezogen wurde, was ihn zu dem Schluss brachte, dass diese Emissionen negative Ladung. Diese Strahlung wurde genannt Strahlenoder Beta-Emissionen (β).
Da Strahlen unter einem elektromagnetischen Feld abgelenkt wurden, führte ihn dies auch zu dem Schluss, dass sie tatsächlich aus Teilchen mit Masse bestehen. Die Masse dieser Partikel war jedoch kleiner als die der Partikel, die die Alpha-Emissionen darstellten, da die β-Partikel eine größere Abweichung erlitten.
- Verfassung:
1900 verglich der französische Physiker Antoine-Henri Bequerel (1852-1908) diese Abweichungen der Beta-Teilchen mit den Verschiebungen, die Elektronen vollzogen, wenn sie auch einem Feld ausgesetzt waren elektromagnetisch. Das Ergebnis war, dass sie gleich waren; damit wurde das gesehen
die Betateilchen waren eigentlich Elektronen.Als Ergebnis ist die Darstellung dieses Teilchens gegeben durch 0-1β oder β-. Beachten Sie, dass die Beta-Emission eine Massenzahl (A) gleich Null hat, da die Elektronen nicht Teil des Atomkerns sind.
- Folgen der Betateilchen-Emission für die Struktur des Atoms:
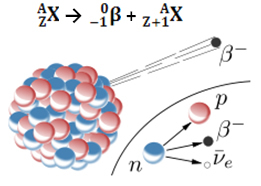
Die Emission eines Betateilchens (0-1β) ist das Ergebnis einer Umlagerung des instabilen Kerns des radioaktiven Atoms, um Stabilität zu erlangen. Daher tritt im Kern ein Phänomen auf, bei dem sich ein Neutron zersetzt und drei neue Teilchen entstehen: ein Proton, ein Elektron (Teilchen β) und ein Neutrino. Antineutrino und Elektron werden emittiert; das Proton bleibt jedoch im Kern.
10Nein →11p + 0-1und + 00ν
Neutron Proton Elektron Neutrino
So, Wenn ein Atom ein Beta-Teilchen aussendet, verwandelt es sich in ein neues Element mit der gleichen Massenzahl (weil die das vorher vorhandene Neutron wurde durch das Proton „ersetzt“, aber seine Ordnungszahl (Z = Protonen im Kern) erhöht sich um a Einheit.
Sehen Sie unten, wie dies im Allgemeinen geschieht:
Hier ist ein Beispiel für einen Beta-Zerfall, der mit dem Isotop 14 des Elements Kohlenstoff auftritt:

Betastrahlung besteht aus Elektronen, die von den Kernen radioaktiver Atome mit hoher Geschwindigkeit emittiert werden. diese Anfangsgeschwindigkeit reicht von 100 000 km/s bis 290 000 km/s und erreicht 95 % der Geschwindigkeit des Licht.
Die Masse der β-Strahlung ist die gleiche wie die eines Elektrons, die 1840-mal kleiner ist als die eines Protons oder Neutrons. Alpha (α)-Strahlung emittiert zwei Protonen und zwei Neutronen, so dass die Masse von α-Teilchen 7360-mal so groß ist wie die von β-Teilchen. Dies erklärt die Tatsache, dass α-Teilchen eine geringere Abweichung erleiden als β-Teilchen, wie Rutherford in seinem Experiment nachgewiesen hatte.
- Durchschlagskraft:
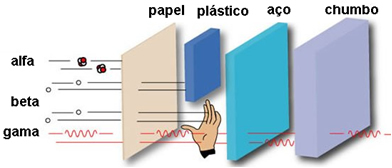
Seine Durchschlagskraft ist mittel, sie ist 50- bis 100-mal stärker durchdringend als Alphateilchen. Diese können ein Blatt Papier durchdringen, werden aber von einem Blatt aus nur 2 mm Blei oder 2 cm Aluminium gehalten. Wenn sie auf den menschlichen Körper einwirken, können sie bis zu 2 cm eindringen.
- Schädigung des Menschen:
Da seine Penetrationskraft über den menschlichen Körper nur 2 cm beträgt, können die β-Partikel die Haut durchdringen und Verbrennungen verursachen, werden jedoch gestoppt, bevor sie die meisten inneren Organe des Körpers erreichen.
Von Jennifer Fogaça
Abschluss in Chemie
