Energiindre er summen af kinetiske energier og potentiale relateret til bevægelsen af de bestanddele atomer og molekyler i en krop. Den interne energi er også direkte proportional med temperatur af kroppen. Det er en skalar størrelse målt i Joule (SI) og bestemt som en funktion af variabler såsom tryk (P), bind (V) og temperatur termodynamik (T) af et system i Kelvin (K).
Jo højere en krops temperatur er, desto større er dens indre energi, jo større er dens evne til at udføre noget arbejde. Desuden er den indre energi af monoatomiske gasser f.eks. Udelukkende givet af summen af kinetisk energi af hvert atom i gassen. Når man beskæftiger sig med molekylære gasser, såsom diatomiske gasser, skal man tage højde for molekylære interaktioner og for dette bestemmes den indre energi af summen af molekylernes kinetiske energi med den potentielle energi der findes imellem de.
Stop ikke nu... Der er mere efter reklamen;)
Intern energi fra ideelle monoatomiske gasser
Da der ikke er nogen interaktion mellem atomerne i en ideel monoatomisk gas, afhænger dens indre energi udelukkende af to variabler: antallet af mol (n) og gastemperaturen (T). Holde øje:
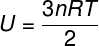
U - intern energi
ingen - antal mol
R - universel konstant af perfekte gasser
T - temperatur
I ligningen ovenfor, R den har et modul på 0,082 atm. L / mol. K eller 8,31 J / mol. K (SI). Vi kan også skrive ovenstående ligning i form af andre størrelser, såsom tryk og volumen. Til det er vi nødt til at huske Clapeyrons ligning, bruges til ideelle gasser.
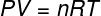
Ved at erstatte ovenstående ligning med den forrige, har vi følgende udtryk til beregning af den interne energi:
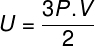
Seogså:Hvad er en perfekt gas?
Under hensyntagen til ovenstående ligninger er det muligt at bestemme et forhold mellem den kinetiske energi af atomerne i en ideel monoatomisk gas og dens temperatur. Til dette vil vi angive, at den kinetiske energi for denne type gas er rentkinetik. Holde øje:
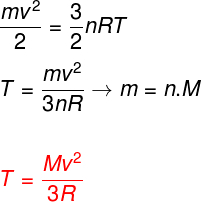
m - pasta
ingen - muldvarp nummer
M - Molar masse
I mange situationer er det interessant at vide, hvordan man beregner variationen i en intern intern energi (ΔU), da denne størrelse angiver, om gassen har modtaget eller gav op energi. Hvis variationen af den interne energi i gassen har været positiv (ΔU> 0), vil gassen have modtaget energi; Ellers (ΔU <0) vil gassen have givet op en del af sin energi.
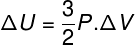
Intern energivariation med hensyn til variation i gasvolumen.
Intern energi til diatomiske gasser
For ideelle diatomiske gasser er den interne energi givet ved en lidt anden ligning.
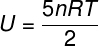
Intern energi i termodynamiske transformationer og cyklusser
Ifølge 1. lov om termodynamik, kan den indre energi af en ideel gas i visse tilfælde variere termodynamiske transformationerafhængigt af mængden af varme, der udveksles mellem omgivelserne og systemet samt det arbejde, der udføres af eller på systemet.
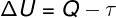
Spørgsmål - varme
τ - arbejde
Lad os derefter se på den form, som denne lov har for nogle specielle termodynamiske transformationer.
Seogså:Historie af termiske maskiner
→ Intern energi: isoterm transformation
På isoterm transformation, er der ingen temperaturændring, og derfor forbliver den interne energi konstant.
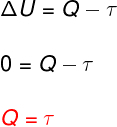
I dette tilfælde omdannes hele den mængde varme, der udveksles med systemet, til arbejde og omvendt.
→ Intern energi: isovolumetrisk transformation
På isovolumetrisk transformation, er det ikke muligt at udføre arbejde, da systemet er begrænset i en stiv og billig container. I dette tilfælde varierer hele den mængde varme, der udveksles med systemet direkte dens interne energi.
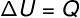
→ Intern energi: isobar transformation
I denne type transformation udsættes systemet for en konstant trykderfor kan det arbejde, der udføres af ham eller på ham, beregnes analytisk.
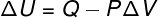
→ Intern energi: adiabatisk transformation
I adiabatiske transformationer, er der ingen varmeudvekslinger mellem systemet og dets omgivelser, derfor afhænger variationen af intern energi udelukkende af det arbejde, der udføres af eller af systemet.
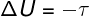
Intern energi i cykliske processer
I hver cyklisk proces er den termodynamiske tilstand i et system, repræsenteret af dets tryk-, volumen- og temperaturvariabler (P, V, T) transformeret, men ender med at vende tilbage til den oprindelige tilstand (P, V, T), derfor er variationen af intern energi i denne type proces altid nul (ΔU = 0).
Seogså:Cykliske transformationer
Se på grafen nedenfor, som viser tre forskellige termodynamiske transformationer mellem tilstande A og B.
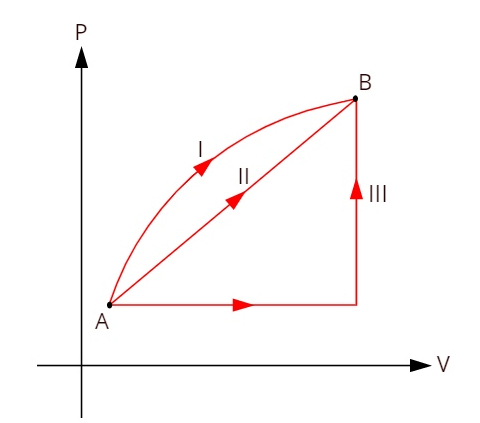
Da de tre transformationer (I, II og III) forlader tilstand A og går til tilstand B, skal den interne energivariation være ens for dem alle, derfor:
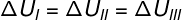
Interne energiøvelser
1) To mol af en ideel diatomær gas med en molær masse lig med 24 g / mol findes ved en temperatur på 500 K inde i en lukket, stiv beholder med et volumen lig med 10-3 m³. Bestemme:
a) Modulet for den interne energi af denne gas i joule.
b) Det tryk, som gassen udøver på beholderens vægge.
Løsning:
Det) Da det er en ideel og diatomisk gas, bruger vi formlen nedenfor til at beregne dens interne energi:
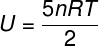
Ved at tage de data, der blev informeret i øvelseserklæringen, har vi følgende beregning, der skal løses:
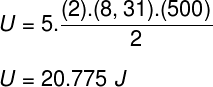
B) Vi kan bestemme det tryk, som gassen udøver, når vi kender volumenet på beholderen: 10-3 m³. For at gøre dette bruger vi følgende formel:
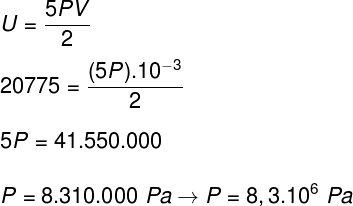
Af mig Rafael Helerbrock