DET Oktetteori siger, at for at et atom af et kemisk element skal være stabilt, skal det tilegne sig den elektroniske konfiguration af en ædelgas, det vil sige, det skal have otte elektroner i valensskallen eller to elektroner, hvis atomet kun har den første elektronskal. (K).
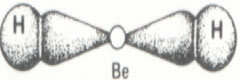
Beryllium har et atomnummer lig med 4. Derfor har dit atom 4 elektroner, og dets elektroniske distribution i jordtilstand er givet af:

Beryllium elektronisk konfiguration
Dette betyder, at beryllium har 2 elektroner i sin sidste skal, der er fra 2A-familien (jordalkalimetaller). Således ville det have tendens til at donere disse to elektroner og få ladningen 2+, det vil sige, det ville have tendens til at danne ioniske bindinger.
Imidlertid observeres det, at berylliumatomer danner kovalente bindinger med elektrondeling, som vist i forbindelsen dannet nedenfor, berylliumhydrid (BeH2):
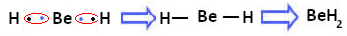
Dannelse af kovalente bindinger af beryllium med brint
Bemærk, at beryllium i dette tilfælde er stabilt med mindre end otte elektroner i sin valensskal, fordi dele sine elektroner som brintatomer, har den nu fire elektroner i sin sidste lag. Det er derfor en
undtagelse fra oktetreglen.Men kovalent binding opstår normalt, fordi elementet har ufuldstændige orbitaler. For eksempel, som vist nedenfor, har hydrogen en ufuldstændig orbital, så det danner kun en kovalent binding. Oxygen har to ufuldstændige orbitaler og danner to kovalente bindinger. Kvælstof har til gengæld tre ufuldstændige orbitaler og danner følgelig tre kovalente bindinger:
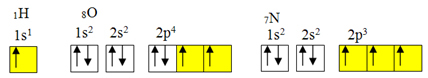
Elektroniske fordelinger af brint, ilt og kvælstof
Som allerede vist har beryllium imidlertid ikke ufuldstændige orbitaler.
Stop ikke nu... Der er mere efter reklamen;)
Så hvorfor laver det kovalente bindinger?
Forklaringen findes i hybridiseringsteori, der siger det når en elektron fra en orbital modtager energi, "springer" den til en yderste tom orbital, opholder sig i den ophidsede tilstand, og dermed forekommer fusion eller blanding af ufuldstændige atomorbitaler, genererer hybrid orbitaler som er ækvivalente med hinanden og adskiller sig fra de oprindelige rene orbitaler.
For eksempel i tilfælde af beryllium modtager en elektron fra subniveau 2s energi og overføres til en subniveau 2p orbital, der var tom:

Beryllium ophidset tilstand til dannelse af hybrid orbitaler
På denne måde har beryllium to ufuldstændige orbitaler, der er i stand til at danne to kovalente bindinger.
Bemærk, at den ene orbital er i et "s" underniveau, og den anden er i "p", så de bindinger, som beryllium ville udføre, skulle være forskellige. Dette er dog ikke, hvad der sker, for med fænomenet hybridisering, disse ufuldstændige orbitaler, der dannes, blandes og genererer to kaldte orbitaler hybrider eller hybridiseret, som er lig med hinanden. Da disse to hybridorbitaler kom fra en "s" orbital og en "p" orbital, siger vi desuden, at denne hybridisering er af typen sp:

Beryllium sp hybridiseringsdannelse
Da hybridorbitalerne er de samme, vil de kovalente bindinger, som beryllium danner med hydrogenatomerne, også være de samme:

Interpenetrationer af hybrid beryllium orbitaler med s orbitaler af hydrogener
Bemærk, at det derefter danner to sigma-obligationer, der er af typen s-sp (σs-sp).
Af Jennifer Fogaça
Uddannet i kemi