Før vi forstår, hvad det magnetiske kvantetal og kvantetal handler om spin, det er nødvendigt at huske, hvad ordet orbital betyder.
Orbital er det område af rummet omkring kernen, hvor sandsynligheden for at finde en bestemt elektron er størst.
For bedre at forstå, tænk på en bikube. Det er ikke muligt med sikkerhed at sige bienes bane og position, men vi kan dog angive regionen omkring bikuben, hvor bierne mest sandsynligt findes. Tilsvarende angiver kredsløbet regionen omkring atomkernen, hvor elektronernes position sandsynligvis vil blive bestemt.
Da elektronen har en dobbelt karakteristik, dvs. at den opfører sig som en partikel og også som en bølge; forskere foretrækker at identificere det i henhold til dets energiindhold. Gennem matematiske beregninger relaterede videnskabsmanden Erwin Schrödinger i 1927 elektronens korpuskulære natur, energi, ladning og masse. Således blev hver elektron karakteriseret ved kvantetal.
Kvantetal er matematiske koder forbundet med elektronenergi.
To bedst kendte kvantetal er
hoved kvantetal (n) og sekundær eller azimutal (der).Den vigtigste indikerer det lag eller energiniveau (K, L, M, N, O, P, Q), hvor elektronen findes, henholdsvis fra 1 til 7. Azimuthal repræsenterer energiniveauet (s, p, d, f), som henholdsvis er 0,1,2,3. Begge vises i det energiske diagram nedenfor, hvor hovedkvantantallet repræsenterer de syv "trapper", og det sekundære kvantetal er repræsenteret af trappen "trapper".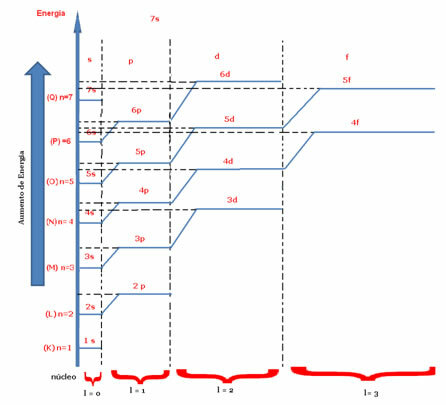
Lad os nu overveje det magnetiske kvantetal og spin:
- Magnetisk kvantetal (m eller mder) → angiver orienteringen af orbitaler i rummet.
Ifølge energidiagrammet nedenfor er værdierne af m repræsenteret af små firkanter (eller af kugler afhængigt af forfatteren). For hver kredsløb har vi en værdi for det magnetiske kvantetal, der varierer fra -der Det+1.
Stop ikke nu... Der er mere efter reklamen;)

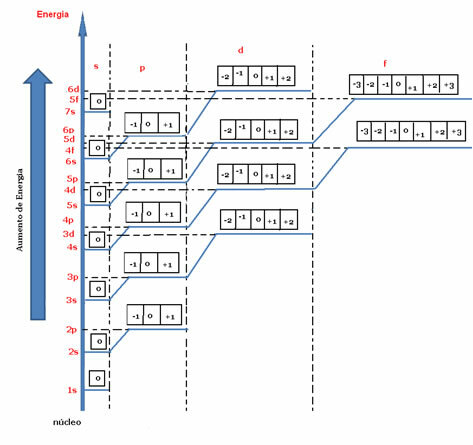
Energidiagram, der angiver det magnetiske kvantetal
-
Kvantumnummer spin (s eller ms)→En orbital har maksimalt to elektroner. De afviser ikke hinanden, fordi de roterer i modsatte retninger og skaber magnetfelter, der tiltrækker hinanden. Så tiltrækningskraften, som er den magnetiske; og frastødning, som er elektrisk, modvægtes.

Modsatte eller antiparallelle spins, elektroner, der drejer i modsatte retninger.
Således repræsenterer vi i hver lille firkant højst kun to elektroner, som er repræsenteret af pile og har værdierne på +1/2 og -1/2.
↑ |
Det repræsenterer ved konvention en elektron med negativ spin s = -1/2.
↓ |
Det repræsenterer ved konvention en elektron med positivt spin s = +1/2.
Lad os som et eksempel se på elementet helium, som har to elektroner og kun et energiniveau; dets symbol er: 2han
↑↓ |
Dens symbolske repræsentation er givet af:
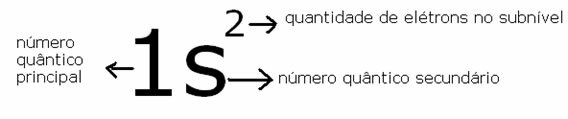
Repræsentation af positionen for den mest energiske elektron i Helium
Så vi har deres kvantetal for 1. og 2. elektron:
1. elektron: 2. elektron:
n = 1 n = 1
l = 0 l = 0
m = 0 m = 0
s = -1/2 s = +1/2
Af Jennifer Fogaça
Uddannet i kemi
Vil du henvise til denne tekst i et skole- eller akademisk arbejde? Se:
FOGAÇA, Jennifer Rocha Vargas. "Kvantumtal: magnetisk (m eller ml) og spin (s eller ms)"; Brasilien skole. Tilgængelig i: https://brasilescola.uol.com.br/quimica/numeros-quanticos-magnetico-m-ou-ml-spin-s-ou-ms.htm. Adgang til 28. juni 2021.

