I henhold til den første lov om termodynamik, i enhver termodynamisk proces mængden af varme Q modtaget af et system er lig med det arbejde, der udføres af det plus variationen i dets interne energi.
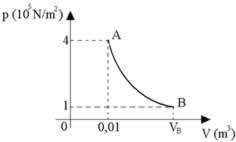
Når trykket er konstant, bruges den varme, der udveksles af systemet med det eksterne medium til arbejde og til at ændre den interne energi. I mange praktiske situationer udsættes systemer for atmosfærisk tryk, som i tilfælde af en kemisk reaktion. Ovenstående figur viser PV-diagrammet for denne type proces.
I dette tilfælde, i ligningen til den første lov,
Q = τ + ∆U
ingen af vilkårene er nul. Værket er skrevet som en funktion af volumenvariation volumen V, såsom:
τ = P.∆V
I det særlige tilfælde af en ideel monoatomisk gas kan energien skrives som følger:
Stop ikke nu... Der er mere efter reklamen;)

Derfor kan vi skrive den første lov om termodynamik som en funktion af AV:


Varmen, der udveksles med mediet, er (5/2) P.ΔV, og 40% af det samlede - hvilket svarer til P. AV - bruges til at udføre arbejde; og (3/2) P.ΔV, der svarer til 60% af det samlede antal, bruges til at ændre den indre energi. Dette resultat gælder for en ideel monoatomisk gas.
Varme er relateret til temperaturvariation (ved hjælp af den ideelle gaslov) af:
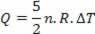
Således kan den tilførte varme beregnes ved temperaturændring eller volumenændring.
Af Domitiano Marques
Uddannet i fysik
Vil du henvise til denne tekst i et skole- eller akademisk arbejde? Se:
SILVA, Domitiano Correa Marques da. "Første lov for isobariske processer"; Brasilien skole. Tilgængelig i: https://brasilescola.uol.com.br/fisica/primeira-lei-para-processos-isobaricos.htm. Adgang til 27. juni 2021.