Gymnasieelever er altid udsat for ansigt redoxreaktioner med ioner, både ved optagelsesprøver og ved National High School Examination (Enem). Således kan afbalancering af disse ligninger være et meget frygtet emne.
For at lette forståelsen af dette emne søger denne tekst at adressere afvejning af redoxligninger med ioner med beskrivelsen af nogle trin til at udføre det. Til dette skal vi starte med at identificere denne type kemisk reaktion.
På redoxreaktioner med ioner identificeres ved tilstedeværelsen af en eller flere komponenter med ladninger (positive eller negative), dvs. ioner (kationer eller anioner), som kan være til stede i reagenser eller produkter, som i de to eksempler a følge efter:
1. eksempel:Cr2O72- + Fe2+ + H+ → Cr3+ + Fe3+ + H2O
2. eksempel:Cl2 + C + H2O → CO2 + H+ + Cl-
At udføre afbalancering af ligninger af redoxreaktioner med ioner, det er vigtigt at følge nogle trin, såsom:
1. trin: bestem NOX af hvert af atomerne i reaktanterne og produkterne i ligningen;
2. trin: Kontroller, hvilken art der har lidt oxidation;
3. trin: Bestem variationen af NOX de arter, der har gennemgået oxidation
4. trin: multiplicer variationen fundet i det tredje trin med antallet af atomer af den oxiderende art;
5. trin: Kontroller, hvilken art der led reduktion;
6. trin: Bestem NOX-variationen af de arter, der gennemgik reduktion;
7. trin: multiplicer variationen fundet i det tredje trin med antallet af atomer af arten, som den reducerer;
8. trin: Brug værdien fundet i det fjerde trin som koefficienten for de arter, der reducerer;
9. trin: Brug værdien fundet i det syvende trin som koefficienten for den oxiderende art;
10. trin: anbring koefficienterne i de andre arter efter metoden til prøvebalancering. I de arter, hvor dette ikke er muligt, skal du sætte ukendte som koefficienter;
11. trin: multiplicere koefficienten for hver art med dens belastning;
12. trin: Udlign summen af ladninger af reaktanter med produkterne for at finde koefficienten for en af arterne med ukendte;
13. trin: færdiggør saldoen ved hjælp af forsøgsmetoden.
For at lette forståelsen skal du følge trin-for-trin beskrevet ovenfor i det følgende eksempel på en redoxligning med ioner:

Ionisk ligning, der viser nogle ioner og generelle ladningsgrupper 0
1. trin: NOX for hvert atom.

NOX af atomer til stede i ligningen
2. trin: Arter, der gennemgår oxidation.

Arter, der gennemgår oxidation i ligningen
Da NOX af iod stiger fra -1 til 0 fra reaktant til produkt, er det derfor arten, der gennemgår oxidation.
3. trin: Bestem NOX-variationen af de oxiderede arter.
For at gøre dette skal du bare trække den højeste NOX fra den laveste NOX:
∆NOX = (0) – (-1)
∆ NOX = 0 + 1
∆ NOX = 1
Trin 4: Multiplikation af NOX efter mængde.
I dette trin multiplicerer vi variationen fundet i det tredje trin med antallet af atomer af arten.
jeg- = ∆NOX.1
jeg- = 1.1
jeg- = 1
5. trin: Arter, der gennemgår reduktion.

Arter, der lider af reduktion i ligningen
Da chrom NOX falder fra +7 til +3 fra reaktant til produkt, er det derfor arten, der gennemgår reduktionen.
6. trin: Bestem NOX-variationen for de reducerede arter.
For at gøre dette skal du bare trække den højeste NOX fra den laveste NOX:
∆NOX = (+6) – (+3)
∆ NOX = +6 – 3
∆ NOX = 3
7. trin: Multiplikation af NOX efter mængde.
I dette trin multiplicerer vi variationen fundet i det sjette trin med antallet af atomer af arten.
Cr2O72- = ∆NOX.1
Cr2O72- = 3.2
Cr2O72- = 6
8. trin: Begynd at balancere.
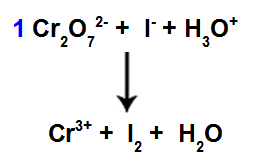
Start af balancering ved hjælp af fundet koefficient
I dette trin starter vi afbalanceringen ved at placere koefficienten, der findes i det fjerde trin i de arter, der led reduktion.
9. trin: Fortsæt med at balancere.

Fortsættelse af afbalancering ved hjælp af den fundne koefficient
10. trin: Brug prøvemetoden.
Der er 6 I-atomer i reaktanten, så vi skal sætte koefficienten 3 i I-arten2 af produktet, fordi der kun er 2 Cl-atomer i det;
Som i art 1, Cr2O72-, der er 2 Cr-atomer, skal vi placere koefficienten 2 i Cr-arten3+ af produktet.
Da vi har ilt i tre arter, og i to af dem er der ingen koefficienter, for at fortsætte balancen skal vi placere ukendte i de resterende arter:
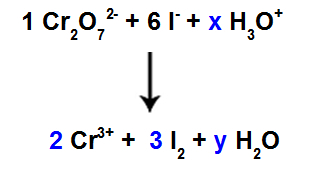
Koefficienter efter brug af forsøgsmetoden
11. trin: Multiplikation af hver art efter dens belastning.
For at gøre dette skal du blot multiplicere artens koefficient med dens belastning som følger:
I reagenserne:
Cr2O72- = 1.(-2) = -2
jeg- = 6.(-1) = -6
H3O+ = x. (+ 1) = + x
På produkterne:
Cr3+ = 2.(+3) = +6
jeg2 = 4.0 = 0
H2O = y.0 = 0
12. trin: Summen af gebyrer.
I dette trin skal vi tilføje de mængder reagenser og produkter, der findes i trin 11:
Reagenser = produkter
-2 + (-8) + (+ x) = +6 + 0 + 0
-2 - 6 + x = 6
-8 + x = 6
x = 6 + 8
x = 14
13. trin: Afslutning på afbalancering.
For at afslutte balanceringen skal vi:
Sæt resultatet fundet i det 12. trin i art H3O+;
Da vi nu har 42 H-atomer i reagenset, er det nødvendigt at placere koefficienten 21 i H-arten2Det i produktet.
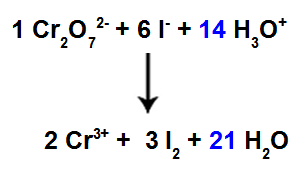
Balanceret ionisk reaktionsligning
Af mig Diogo Lopes Dias
Kilde: Brasilien skole - https://brasilescola.uol.com.br/quimica/reacoes-oxirreducao-com-ions.htm
