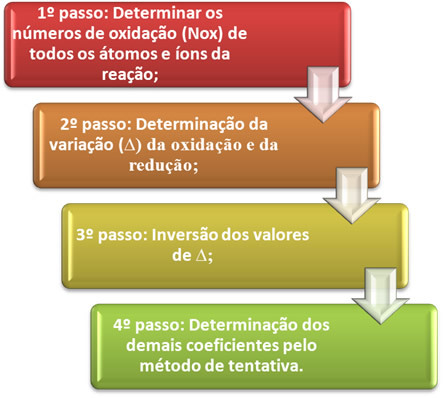
O afbalancering af en oxidationsreduktionsligning det er baseret på ligestillingen mellem antallet af elektroner, der er givet væk med antallet af elektroner, der modtages. En enkel metode til at udføre denne afbalancering gives ved følgende trin:
Lad os se i praksis, hvordan vi anvender disse trin gennem følgende eksempel:
Reaktion mellem en vandig opløsning af kaliumpermanganat og saltsyre:
kmnO4 + HCI → KCl + MnCl2 + Cl2 + H2O
*1. trin:Bestem oxidationstal:
Dette trin er vigtigt, fordi vi normalt ikke hurtigt kan visualisere, hvilke arter der gennemgår oxidation og reduktion.
+1 +7 -2 +1 -1 +1 -1 +2 -1 0 +1 -2
kmnO4 + HCI → KCl + MnCl2 + Cl2 + H2O
*2. trin:Bestemmelse af oxidations- og reduktionsvariation:

Bemærk, at mangan (Mn) reduceres, og klor (Cl) oxideres.
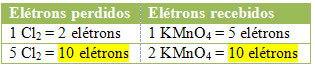
MnCl2 = ∆Nox = 5
Cl2 = ∆Nox = 2
I tilfælde af klor kan vi bemærke, at HCI gav anledning til 3 forbindelser (KCl, MnCl2og Cl2), men hvad der interesserer os er Cl2, fordi det er din Nox, der har lidt variation. Hvert klor, der danner Cl2 miste 1 elektron; da det tager 2 klorer at danne hver Cl2, så går to elektroner tabt.
3. trin:Inversion af ∆-værdier:
I dette trin udveksles værdierne for between mellem de nævnte arter og bliver deres koefficienter:
MnCl2 = ∆Nox = 5 → 5 vil være koefficienten for Cl2
Cl2 = ∆Nox = 2→ 2 vil være koefficienten for MnCl2
kmnO4 + HCI → KCl + 2 MnCl2 + 5 Cl2 + H2O
På dette tidspunkt er det allerede muligt at kende to koefficienter i ligningen.
Observation: normalt, i de fleste reaktioner, udføres denne tilbageførsel af værdier på det første medlem. Men som hovedregel skal dette gøres i det medlem, der har det største antal atomer, der gennemgår redox. Hvis dette kriterium ikke kan opfyldes, vender vi værdierne for det medlem med det højeste antal kemiske arter. Dette er hvad der blev gjort her, da det andet medlem har flere stoffer.
4. trin: Trial balancing:
kmnO4 + HCI → KCl + 2 MnCl2 + 5 Cl2 + H2O
- Da der i det andet medlem er to manganatomer, som vist ved koefficienten, i det første skal der også være. Så vi har:
2 kmnO4 + HCI → KCl + 2 MnCl2 + 5 Cl2 + H2O
- Således var mængden af kalium (K) i det første medlem 2, hvilket vil være den samme koefficient for dette atom i det andet medlem:
2 kmnO4 + HCI → 2 KCl + 2 MnCl2 + 5 Cl2 + H2O
- Mængden af klor (Cl) i det andet medlem er i alt 16, så HCI-koefficienten for det første medlem vil være:
2 kmnO4 + 16 HCI → 2 KCl + 2 MnCl2 + 5 Cl2 + H2O
- Antallet af hydrogener i det første medlem er 16, deraf vandkoefficienten (H.2O) for det andet medlem vil være lig med 8, da multiplikationen af hydrogenindekset (2) med 8 er lig med 16:
2 kmnO4 + 16 HCI → 2 KCl + 2 MnCl2 + 5 Cl2 + 8 H2O
- For at kontrollere om ligningen er korrekt afbalanceret kan vi se to kriterier:
1.) Kontroller, om mængden af hvert atom i de to medlemmer er lige:
2 kmnO4 + 16 HCI →2 KCl + 2 MnCl2 + 5 Cl2 + 8 H2O
K = 2K = 2
Mn = 2 Mn = 2
Cl = 16 Cl = 16
H = 16 H = 16
O = 8 O = 8
2.) Se om det samlede antal mistede elektroner er lig med det samlede antal modtagne elektroner:
Af Jennifer Fogaça
Uddannet i kemi
Kilde: Brasilien skole - https://brasilescola.uol.com.br/quimica/balanceamento-por-oxirreducao.htm
