I teksten "Igneøs elektrolyse”, Blev det forklaret, at denne proces opstår, når en elektrisk strøm føres i et smeltet stof (i flydende tilstand) uden tilstedeværelse af vand og på denne måde modtager kationen elektroner, og anionen donerer elektroner, så begge har en elektrisk ladning lig med nul og energi akkumuleret.
For bedre at forstå, hvordan magmatisk elektrolyse opstår, lad os overveje et af de vigtigste eksempler på denne type proces, elektrolyse af natriumchlorid eller bordsalt (NaCl).
Natriumchlorid dannes i naturen gennem overførsel af en elektron fra natrium (Na) til klor (Cl) i henhold til nedenstående reaktion:
2Na (s) + 1Cl2(g) → 2NaCl (s)

Denne proces er spontan, men den omvendte proces med denne reaktion er ikke spontan, det vil sige produktionen af chlorgas (Cl2(g) - figur nedenfor) og metallisk natrium (Na (s)) forekommer ikke i naturen. Hvis vi ønsker, at dette skal ske, bliver vi nødt til at starte processen.
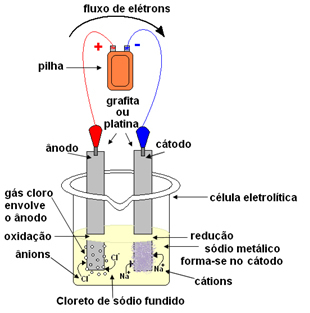
Dette kan gøres ved magtfri elektrolyse. Saltet opvarmes til en temperatur over 800,4 ° C, hvilket er dets smeltepunkt; og på denne måde smelter det sammen og går fra fast til væske. I denne fysiske tilstand, dine Na-ioner
+ og Cl- er gratis.Det smeltede salt anbringes derefter i en beholder, den elektrolytiske beholder, og to inerte platin- eller grafitelektroder dyppes i natriumchloridet. Disse elektroder er forbundet til en kilde, der genererer jævn elektrisk strøm, såsom et batteri eller en celle.
Ved passage af elektrisk strøm sker følgende:
- Den negative pol på batteriet eller cellen tilfører elektroner til en af elektroderne, som bliver katoden;
- Katode: modtager elektronerne fra cellen og bliver den negative pol, der tiltrækker Na-kationerne+, fordi modsatte ladninger tiltrækker. Disse ioner modtager elektronerne fra elektroden (katoden), og deres reduktion forekommer og danner metallisk natrium:
Reduktion:På+(ℓ) + og- → I(s)
Metallisk natrium aflejres oven på elektroden og sendes til et reservoir.
- Anode: bliver positivt ladet og tiltrækker Cl-anioner- (det kaldes derfor en anode). Disse ioner mister deres elektroner, når de kommer i kontakt med anoden, og derfor gennemgår de oxidation og danner kloratomer, som straks kombinerer to og to for at danne klorgas:
Oxidation:2Cl-(ℓ) → 2 og- + 1Cl2(g)
Denne gas bobler rundt om anoden og opsamles af et glasrør tilpasset systemet.
Således er den samlede reaktion, der forekommer i dette tilfælde, givet af:
Katode: 2Na+(ℓ) + 2e- → 2Na(s)
Anode: 2Cl-(ℓ) → 2 og- + 1Cl2(g) ____________
Global reaktion: 2Na+(ℓ) + 2Cl-(ℓ) → 2Na(s) + 1Cl2(g)
Et andet vigtigt aspekt at være opmærksom på, som blev fremhævet i slutningen af den nævnte tekst (Igneøs elektrolyse), er, at til elektrolyse opstår, skal cellen eller batteriet, der bruges til at generere den elektriske strøm, have en ddp (potentialforskel), der er lig med eller større end potentialets forskel på reaktion.
Lad os se på dette i tilfælde af natriumchlorid-elektrolyse, vi overvejer. For at finde ud af den potentielle forskel ved denne reaktion er det nok at reducere katodens standardreduktionspotentiale med anodens. Dette forklares i teksten. Potentiel forskel på et batteri .
Gennem tabellen over standardreduktionspotentialer (E0rød), vi ved, at:
På+(ℓ) + og- → I(s) OG0rød = -2,71
2Cl-(ℓ) → 2 og- + 1Cl2(g) OG0rød = +1,36
Nu skal du bare reducere disse værdier for at kende den potentielle forskel i den globale reaktion:
NdOg0 = OG0rød (katode) - OG0rød (anode)
NdOg0 = -2,71 – (+ 1,36)
NdOg0 = - 4,07 V.
Derfor betyder dette, at den celle eller det batteri, der skal bruges, skal have en spænding, der er lig med eller større end 4,07 V for at udføre den magtfulde elektrolyse af natriumchlorid.
Den negative værdi indikerer kun, at det er en ikke-spontan proces.. I tilfælde af batterier, som er en spontan proces, er den elektromotoriske kraftværdi (∆E0) giver altid positivt.
Af Jennifer Fogaça
Uddannet i kemi
Kilde: Brasilien skole - https://brasilescola.uol.com.br/quimica/eletrolise-Ignea-cloreto-sodio.htm

