Kulstofatomet er tetravalent, det vil sige, det har kapacitet til at danne fire kovalente bindinger, som kan være enkelt, dobbelt eller tredobbelt. Desuden kan disse bindinger forekomme med andre kulstofatomer eller med atomer af andre kemiske grundstoffer. Takket være denne egenskab har kulstof en unik kapacitet, som er at fortsætte med at oprette disse forbindelser og danne kæder, som kan være korte eller lange.
Dette sæt af carbonatomer bundet sammen og af heteroatomer, der udgør "skeletet" af organiske molekyler kaldes kulstofkæder.
Da kulstof er i stand til at danne et meget stort antal forbindelser, blev disse klassificeret i henhold til nogle kendetegn ved dets kæder for at lette deres undersøgelse og for os bedre at forstå deres ejendomme.
Hovedklassificeringen af disse forbindelser er:
1. Åbne eller acykliske kæder: Er de der har to frie ender eller mere. Atomkæden gennemgår ingen lukning. Se nogle eksempler:
H3Ç? CH2? CH2? CH3 H3Ç? CH? CH? CH3 H3Ç? CH? CH3
?
CH3
2. Lukkede kæder:
Det er dem, der ikke har nogen frie ender, da atomerne binder sammen for at danne en ring eller cyklus. Eksempler:
Eksempler på lukkede kulstofkæder
Observation: Åbne og lukkede kæder, der ikke har en aromatisk ring (første struktur i nederste række i billedet ovenfor) kaldes også alicykliske.
3. Blandede kæder: Det er dem, der har mindst en fri ende og en cyklus, dvs. de har mindst en åben og en lukket del. Eksempler:
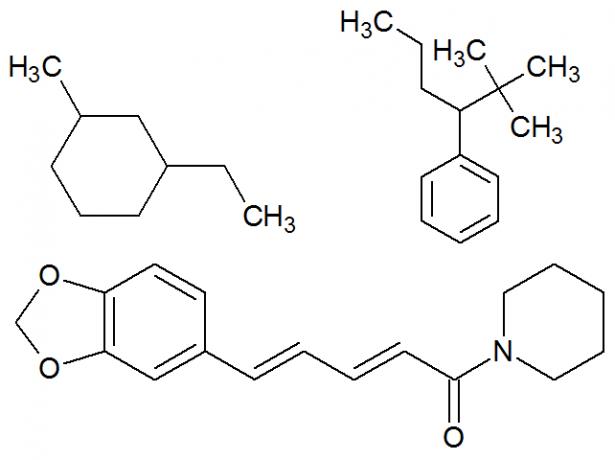
Eksempler på blandede kulstofkæder
Disse tre hovedgrupper er også klassificeret efter andre underinddelinger som vist i diagrammet nedenfor:
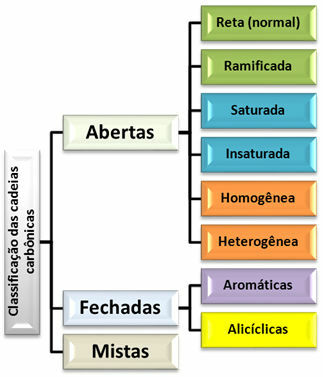
Klassificeringsskema for kulstofkæder
Hvis du vil vide mere om hver af disse klassifikationer, skal du læse teksten Klassificering af kulstofkæder, i afsnittet om Organisk kemi.
Af Jennifer Fogaça
Uddannet i kemi
Kilde: Brasilien skole - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-classificacao-das-cadeias-carbonicas.htm
