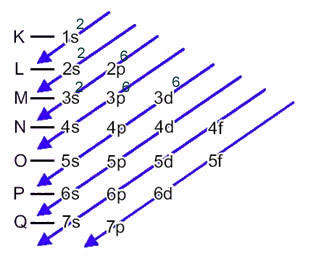
Den elektroniske distribution af et atoms elektroner i neutral eller grundlæggende tilstand udføres almindeligvis med Pauling-diagram, vist nedenfor:
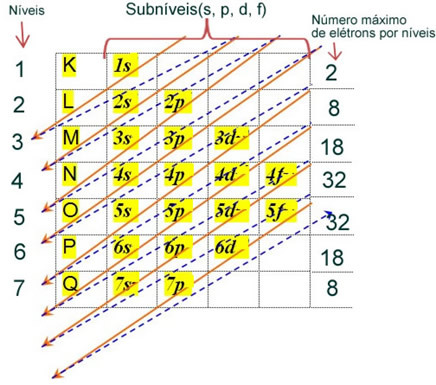
De detaljerede regler for denne distribution kan findes i følgende to tekster på vores hjemmeside: “Elektronisk distribution af elektroner"og"Elektroniske distributionsregler”.
Den elektroniske distribution af ioner fungerer oprindeligt på samme måde som for atomer i neutral tilstand; med kun en forskel. Da en ion er et atom, der har fået eller mistet elektroner, skal vi tage dette i betragtning og gøre følgende:

En vigtig observation er: ændringen sker på det yderste underniveau og ikke det mest energiske.
hvis ionen er en kation, vi skal fjern elektronerne at han tabte. Lad os se på et eksempel:
Jernatomet (atomnummer = 26) har følgende elektroniske fordeling i underniveauer i energisk rækkefølge: 1s2 2s2 2p6 3s2 3p6 4s2 3d6. Med hensyn til de elektroniske lag har vi: K =2; L = 8; M = 14; N = 2.
Denne fordeling er vist i nedenstående Pauling-diagram:
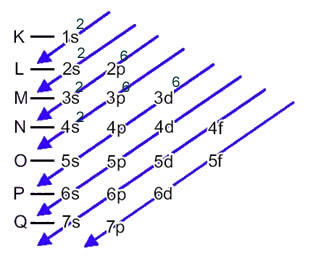
Når jernatomet mister 2 elektroner, bliver det til Fe-kationen.2+. Så når du foretager din elektroniske distribution, skal vi fjern 2 elektroner fra den sidste skal(N) og ikke det mest energiske underniveau, som vist nedenfor:
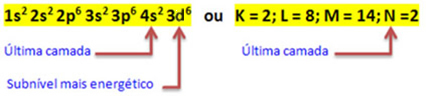
Således den elektroniske distribution af Fe kationen2+ er givet af:
1s2 2s2 2p6 3s2 3p6 3d6 eller K = 2; L = 8; M = 14
Nu, hvis vi skal udføre den elektroniske distribution af en anion, vi skal tilføj de elektroner, den modtog.Se hvordan dette gøres i følgende eksempel:
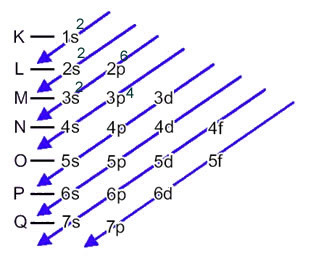
Svovlanionen (16s2-) er dannet af svovlatomet (16S) ved forstærkning af 2 elektroner, som angivet ved ladning 2-. Dens elektroniske distribution på grundtilstand gives af:
1s2 2s2 2p6 3s2 3p4 eller K = 2; L = 8; M = 6
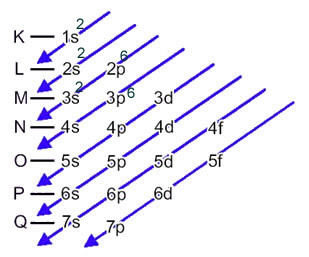
I dette tilfælde er det sidste delniveau det samme som energiniveauet, 3p. Så vi tilføjer det de to elektroner af svovlanionen:
1s2 2s2 2p6 3s2 3p6 eller K = 2; L = 8; M = 8
Af Jennifer Fogaça
Uddannet i kemi
Kilde: Brasilien skole - https://brasilescola.uol.com.br/quimica/distribuicao-eletronica-ions.htm