I studiet af termologi kalder vi det adiabatiske transformationer de gasformige transformationer, hvor der ikke er nogen varmeveksling med det ydre miljø. Derfor er varmen nul ved den adiabatiske transformation.
Q = 0
Hvis vi anvender termodynamikens første lov, har vi:
Q = ∆U + τ
∆U = - τ
Men hvad betyder det, at der ikke er nogen varmeudveksling mellem det eksterne miljø? Det betyder, at hvis der sker en gasformig ekspansion, og gassen udfører et 300 J-job, gør det det ikke hvis der er varmeudveksling med mediet, vil variationen af gassens indre energi være negativ, derfor vi vil have:
∆U = - 300 J
Hvis der nu er et fald i gassens indre energi, kan vi sige, at der også var et fald i gassens temperatur. Fra den generelle lov om gasser

vi kan sige, at hvis volumen øges og gastemperaturen falder, vil gastrykket nødvendigvis også falde. Generelt kan vi sige, at det samme sker med kompression, for hvis der er kompression, vil den interne energi i gassen stige, så trykket også øges.
Mind Map: Adiabatic Transformation
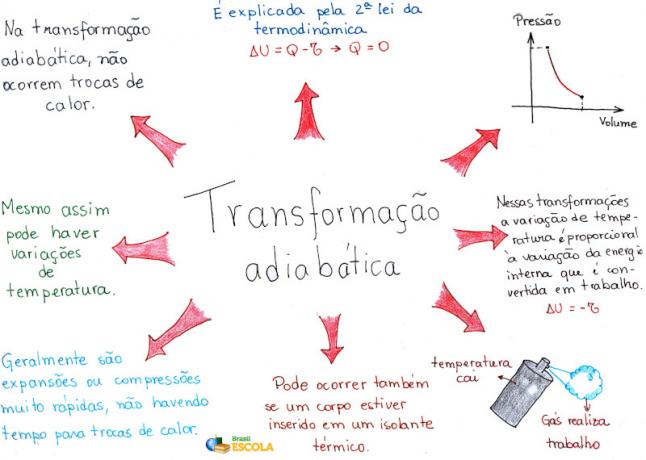
* For at downloade tankekortet i PDF, Klik her!
Kort sagt kan vi sige det:
- i adiabatisk ekspansion, temperatur og trykfald;
- i adiabatisk kompression øges både temperatur og tryk.
Diagrammet nedenfor giver os et overblik over den adiabatiske transformation:
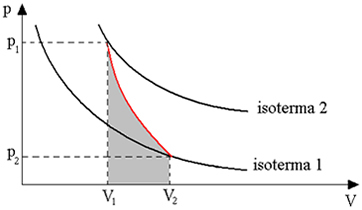
Adiabatiske transformationer opnås ved hjælp af termisk isolerede beholdere eller også ved kompression eller meget hurtig ekspansion.
Således kan vi konkludere, at når en gas udveksler varme med det ydre miljø, tager det noget tid for varmen at forplante sig gennem den gasformige masse og for at den kommer i ligevægt. Derfor, når både ekspansion og hurtig kompression udføres, er der praktisk talt ingen varmeudveksling med det eksterne miljø.
* Mind Map af mig.Rafael Helerbrock
Af Domitiano Marques
Uddannet i fysik
Kilde: Brasilien skole - https://brasilescola.uol.com.br/fisica/estudo-transformacao-adiabatica.htm
