
Mængden af kalorier afhænger af madens sammensætning. For at eksperimentelt bestemme mængden af varme, der frigøres af maden, og som kan absorberes af kroppen, bruger vi en enhed kaldet kalorimeter.
Denne enhed måler varmen, der frigøres af maden, når den brændes. Der findes flere typer kalorimeter; den første af dem blev oprettet i 1780 af Lavoisier og Laplace og var en iskalorimeter.
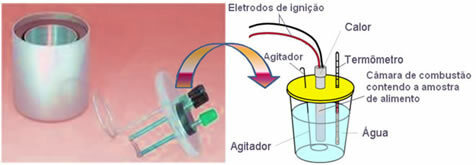
I dag er det mest anvendte, og der tager højde for kaloriebegrebet forklaret ovenfor, det vandkalorimeter. Denne enhed er belagt med et isolerende materiale for at forhindre varmetab fra mediet; og den mad, der skal analyseres, placeres i forbrændingskammer, som indeholder iltgas og elektroder. Disse elektroder gennemgår elektrisk afladning og forårsager antændelse og forbrænding af mad.
Den kendte vandmasse indeholdt i kalorimeteret absorberer varmen, der frigives af den brændte mad, og a termometer måler stigningen i vandtemperatur. Derudover indeholder kalorimeteret en omrører hvilket tillader vandets temperatur at forblive ensartet i hele sin helhed.
Så hvis vi f.eks. Bruger en masse på 1 gram sukker, og kalorimeteret har 1000 g vand, og vi observerer det i sidste ende af reaktionen, vandtemperaturen gik fra 20 ° C til 24 ° C, det vil sige den steg med 4 ° C, kan vi derefter nå energiværdien af sukker. Synes godt om? I betragtning af det oprindelige kaloriebegreb har vi:
| Hæv fra 1 ° C → 1 cal pr. Gram vand |
| Hæv fra 4 ° C → 4 cal pr. Gram vand |
Så 1 g vand absorberer 4 kalk. Imidlertid blev der brugt 1000 g vand, og i betragtning af at al den varme, der frigives i forbrændingen, blev absorberet af den, var den samlede energi, der blev absorberet af vandet, 4000 cal eller 4 kcal. Derfor konkluderer vi, at:
| Energiværdien af sukker = 4000 cal / g eller 4 kcal / g. |
Transformering til SI:
1 kcal 4,18 kJ
4 kcal / g x
x = 16,72 kJ / g
Derudover kan vi bruge følgende ligning til at beregne den mængde varme, der er opgivet eller absorberet af vand:
| Q = m. ç. t |
Hvor:
Q = varme opgivet eller absorberet af vand;
m = vandmasse;
c = specifik vandvarme, der er lig med 1,0 cal / g. ° C eller 4,18 J / g. ° C;
Δt = variation af temperaturen, som vandet lider, hvilket er givet ved faldet i den endelige temperatur med den indledende (tf - tjeg).
Ved hjælp af denne formel får vi det samme resultat:
Q = m. ç. t
Q = 1000 g. 1,0 cal / g. ° C. (24-20) ° C
Q = 4000 kal
Q = 4,0 kcal
eller
Q = m. ç. t
Q = 1000 g. 4,18 kJ / g. ° C. (24-20) ° C
Q = 16,72 kJ
Af Jennifer Fogaça
Uddannet i kemi
Kilde: Brasilien skole - https://brasilescola.uol.com.br/quimica/medindo-as-calorias-dos-alimentos-por-meio-um-calorimetro.htm

