Osmose er bevægelsen af opløsningsmidlet (vand) gennem a membransemipermeabel fra det mindst koncentrerede medium til det mest koncentrerede medium for at udligne koncentrationerne på begge sider. Hedder osmotisk trykdet tryk, der skal anvendes på opløsningen for at stoppe indtrængen af vand.
→ Hvordan opstår osmose?
Forestil dig følgende situation: findes i en container toløsninger med forskellige koncentrationer af opløste stoffer, der er adskilt af en selektivt permeabel membran. Denne membran tillader passage af opløsningsmiddel (vand), men tillader ikke passage af opløst stof. På den ene side af membranen har vi en opløsning med en lav koncentration af opløst stof og på den anden side en opløsning med en høj koncentration af opløst stof.

Bemærk, at i osmose går vand fra det mindst koncentrerede medium til det mest koncentrerede medium.
I denne situation observeres det, at vand bevæger sig fra den mindre koncentrerede opløsning til området af opløsningen med højere koncentration gennem den selektivt permeable membran. Vandets bevægelse forbliver indtil
opløste koncentrationer på begge sider af membranen er ens. Denne vandbevægelse bestemmes ud fra osmose.Læs også: Omvendt osmose ved afsaltning af havvand
→ Osmose i dyreceller
Dyrecellen viser forskellige reaktioner, når den placeres i opløsninger med forskellige koncentrationer. Lad os overveje en isotonisk opløsning, en hypertonisk opløsning og en hypotonisk opløsning. Når vi sammenligner to løsninger, og de har den samme koncentration af opløst stof, siger vi, at det er isotonisk. Når man har en større mængde opløst stof, kaldes det hypertonisk. Endelig har vi løsningen med den mindste mængde opløst stof, der kaldes hypotonisk.
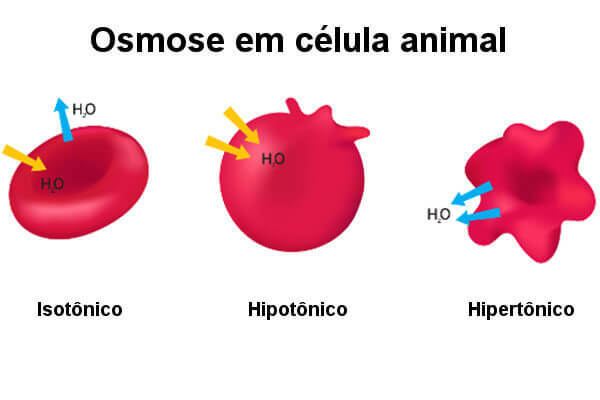
Se hvad der sker med dyreceller, når de udsættes for forskellige løsninger.
Hvis vi placerer en dyrecelle i et miljø isotonisk, vand strømmer i samme forhold ind i og ud af cellen. I denne situation observerer vi det cellevolumen ændres ikke. Når en dyrecelle placeres i en opløsning hypotonisk, der observeres en stigning i vandindtrængen i cellen ved osmose. I dette tilfælde øger vandet cellevolumenet hurtigt og forårsager dets forstyrrelse (lysis).
Hvis en dyrecelle placeres i et miljø hypertonisk, vi bemærker, at cellen mister vand til miljøet gennem osmose. I dette tilfælde kontrollerer vi, at celle visner og kan dø. Vi indså derfor, at en celle uden en cellevæg overlever godt i isotoniske miljøer, men det samme sker ikke, når det udsættes for hypertoniske eller hypotone forhold.
Derfor har mange organismer mekanismer til at undgå disse problemer. O Paramecium, for eksempel findes den i hypotone miljøer, men for at undgå overdreven vandabsorption har den en vakuolkontraktil. Denne vakuol fungerer som en pumpe, der tvinger overskydende vand ud af protozoan cellen.
Læs også: Hvad er en vakuole?
→ Plantecelle osmose
DET plantecelle, såvel som cellerne i nogle svampe og prokaryoter har de en cellevæg. Denne væg hjælper celler med at overleve i hypotoniske og hypertoniske omgivelser. På grund af tilstedeværelsen af en mur opfører den sig forskelligt fra dyrecellen. Denne struktur virker ved at forhindre overdreven vandindtrængning.
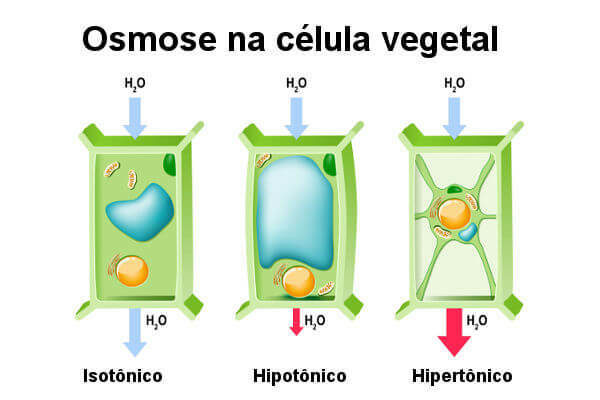
Se hvad der sker med planteceller, når de udsættes for forskellige løsninger.
Når vi sætter en plantecelle i opløsning hypotonisk, vand kommer ind i denne celle ved osmose. I modsætning til dyrecellen bryder den imidlertid ikke, da cellevæggen tillader indgang til vand kun op til et bestemt punkt efter denne periode for at udøve et modtryk, der forhindrer indtrængen af Vand (turgortryk).
På dette tidspunkt siger vi, at cellen er svær, hvilket er den ideelle situation for en plantecelle. Turgor er vigtig, især for de ikke-træagtige planter, da det garanterer næring. Når plantecellen placeres i et medium isotonisk, det er ikke muligt at observere en tendens til, at store mængder vand kommer ind i cellen. I denne situation er cellen slap.
Endelig har vi plantecellen i et miljø hypertonisk. I denne situation mister cellen vand og vilter. Interessant nok får tabet af vand i denne celle plasmamembranen til at løsne sig i nogle områder af cellevæggen. Vi siger, at i denne situation lider cellen plasmolyse. Plasmolyseprocessen kan vendes, hvis cellen placeres i rent vand.
→ Osmose i hverdagen
Osmose kan observeres i vores daglige liv. Når vi f.eks. Laver en salat med salat, bemærker vi, at bladene oprindeligt er prangende, men efter tilsætning af salt visner bladene. Dette sker, fordi vi skabte et hypertonisk medium, som fik vandet til at forlade planten gennem osmose. Efterladende vand får bladene til at visne.
Læs også: Aktiv og passiv transport
→ Forskel mellem osmose og simpel diffusion
Både osmose og simpel diffusion er eksempler på passiv transport af stoffer over plasmamembranen, det vil sige en transport af stoffer, hvori ingen energiforbrug overholdes. Imidlertid adskiller simpel diffusion sig fra osmose, fordi vi i det første tilfælde observerer bevægelsen af opløst stof, mens vi i osmose observerer bevægelsen af vand (opløsningsmiddel).
Af Ma Vanessa Sardinha dos Santos
