Du metaller de er kemiske grundstoffer, der præsenterer deres vigtigste fysiske egenskab evnen til at miste elektroner og dermed danne metalliske kationer. Af denne grund kan de danne to typer kemiske bindinger: den ioniske binding og den metallisk binding.
DET ionbinding opstår, når et metal interagerer med et element af metallisk art, som kan være en ametal eller hydrogen. I denne type binding har vi tabet af elektroner af metallerne og gevinsten af elektroner af ikke-metaller eller brint.
allerede den metallisk binding er etableret mellem atomerne i et enkelt metallisk element. Denne type binding forekommer kun mellem atomerne i et enkelt metal og udelukkende fordi et metal ikke kan etablere en kemisk binding med et andet andet metalelement.
Generelle egenskaber ved metaller
Tørstof ved stuetemperatur med undtagelse af kviksølv;
De er strålende;
De har høje smelte- og kogepunkter;
De er generelt sølvfarvede med undtagelse af guld, som er gyldent, og kobber, som er rødligt;
Rene metaller dannes af klynger af atomer (af et enkelt kemisk element) kaldet krystalgitter.
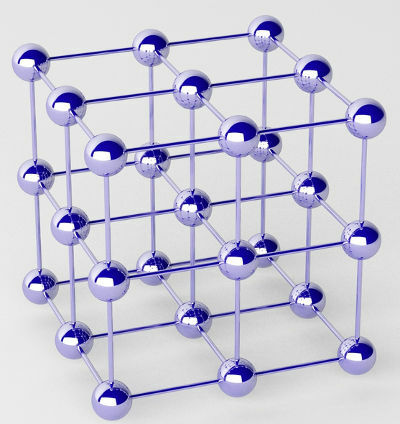
Repræsentation af det krystallinske gitter af et metal
Principper for metalbinding
På metallisk binding, de krystallinske gitter, der danner metallerne, er faktisk en ionisk klynge (kun sammensat af kationer og elektroner). Elektronerne, der er til stede i metalatomernes valenslag, delokaliseres, dvs. de forlader valenslaget, hvilket får atomet til at blive en kation (mangler elektroner).
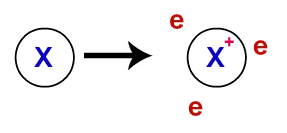
Repræsentation af delokaliserede elektroner fra valensskallen
Efter at være blevet aflokaliseret begynder elektronerne fra metalatomer at omgive kationerne og danne et ægte ”elektronhav”. Hver af de elektroner, der er til stede i dette hav, har evnen til at bevæge sig frit gennem det krystallinske gitter af metallet.

Repræsentation af elektronhavsmodellen
BEMÆRK: Elektroner “fra havet” er ikke i stand til at forlade krystalgitteret og bevæge sig gennem det.
Egenskaber for metaller retfærdiggjort ved metalbinding
a) formbarhed
Via et metal er det muligt at fremstille plader med forskellige tykkelser og plader. Det er takket være denne egenskab af metaller, at vi kan bygge forskellige genstande, såsom knive, sværd osv.

Sværdbladet er lavet af et metal
b) Ledningsevne
Metaller er generelt gode ledere af elektrisk strøm og varme. Når ethvert metal er i kontakt med en varmekilde eller en kilde til elektrisk strøm, er det i stand til at lede dem.

En aluminiumsgryde i ovnens flamme bliver helt varm på grund af ledningsevne.
c) Sejlbarhed
Via et metal kan vi producere ledninger. Brugen af et metal i form af ledninger letter dets anvendelse, især i forhold til elektrisk ledningsevne.

Et metal, såsom kobber, kan bruges til at producere ledninger.
Af mig Diogo Lopes Dias
Kilde: Brasilien skole - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-ligacao-metalica.htm

