Når man udfører nomenklaturen for organiske forbindelser, er en af hovedvanskelighederne for kemistuderende nomenklaturen for forgreningerne og de substituerende organiske radikaler. I denne tekst vil vi se, hvilke er de vigtigste grupper af grene og radikaler, der vises i kulstofkæder, og hvordan man navngiver dem uden fejl.
Når hovedkæden er valgt og nummereret, betragtes alle resterende kæder som grene. Navnet på disse grene skal komme foran navnet på hovedkæden i alfabetisk rækkefølge og med det kulstofnummer, som grenen kommer fra.
Navnene på disse filialer skal dog tage to vigtige oplysninger i betragtning. Lad os se på hver af dem:
1. Bindingstypen mellem kulstofferne:
I tilfælde af mættede grene, det vil sige, der kun har enkeltbindinger mellem deres kulstoffer, vil navnet følge følgende regel:

Dette betyder, at deres navne er afledt af den tilsvarende alkan og ændrer slutningen af ANO til IL eller ILA (deraf det generiske navn for alkyl- eller alkylgrupper). Se eksemplet:
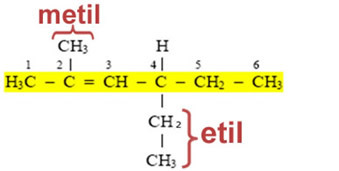
Ud over disse organiske grupper, der kun har enkle bindinger mellem carbonatomer; der er andre, der stammer fra umættede forbindelser og aromatiske forbindelser. Navnene på rektorerne er vist nedenfor:

2. Typer af kulstof, hvor valensen, der forbinder grenen med hovedkæden, findes:
I gymnasiet er det også almindeligt at studere de grene, der kun er knyttet til hovedkæden gennem et simpelt link, der kaldes monovalent.
På dette tidspunkt er det interessant at kende forskellen mellem en organisk gruppe og en substituent.
Når en organisk forbindelse lider a homolytisk opdeling, det vil sige et brud i bindingen mellem et carbonatom og et hydrogenatom i kæden, hvor hvert atom tager en elektron fra bindingen; vi siger, at en radikal. Således er en organisk gruppe en isoleret gren, som ikke er bundet til kæden.
Men radikaler er yderst ustabile og reaktive kemiske arter, der let kan træde i stedet for et andet atom (normalt hydrogen) i carbonkæden. Når det sker, bliver det en erstatning.
normalt bruger præfikser i navnene på disse substituenter for bedre at præsentere deres struktur. De vigtigste er anført nedenfor:
- Det her: dette præfiks bruges, når den frie valens er placeret på det primære kulstof i en forgrenet kæde. Det bruges typisk til at identificere radikaler, der har følgende generelle struktur:
H3Ç CH ─ (CH2)ingen─
|
CH3
Hvor n kan tage værdier på 0, 1, 2, 3 osv.
Eksempler:

- Sek- eller s-: dette præfiks bruges til at indikere fri valens på det sekundære kulstof. Eksempler:
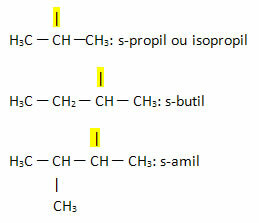
- Tredje- eller t-: dette præfiks bruges til at indikere, at den frie valens er placeret på tertiært kulstof.
Eksempler:

- Neo- eller n-: dette præfiks indikerer, at den frie valens er placeret på det primære kulstof og generelt indikerer tilstedeværelsen af følgende gruppe:
CH3
|
H3Ç ─C ─ (CH2)ingen─
|
CH3
Eksempler:
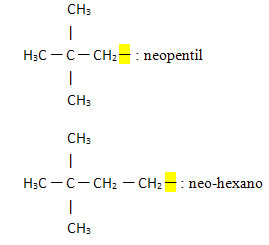
Nedenfor har vi også nogle eksempler på organiske grupper divalent og trivalenter:
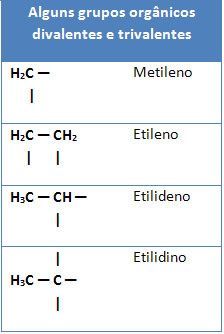
Af Jennifer Fogaça
Uddannet i kemi
Kilde: Brasilien skole - https://brasilescola.uol.com.br/quimica/nomenclatura-ramificacoes.htm
