Sulfoneringsreaktioner i alkaner de er organiske substitutionsreaktioner, udført med det formål at producere sulfonsyrer (organiske forbindelser, der har SO-gruppen3H bundet til et carbonatom eller til en carbonkæde) og vand (H2O).
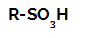
Strukturformel af en sulfonsyre
Til udførelse af en sulfoneringsreaktion på alkaner, skal vi blande en alkan (forbindelse dannet af en carbonkæde mættet med kun kulstof- og hydrogenatomer) og svovlsyre (H2KUN4koncentreret, udsat for opvarmning (∆).
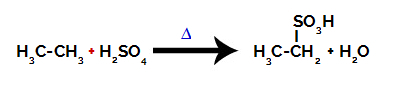
Kemisk ligning, der repræsenterer sulfoneringen af en to-carbon-alkan
Principper for sulfoneringsreaktionen i alkaner
Såsom alkansulfoneringsreaktion det er en substitutionsreaktion, vi har en udveksling mellem mindre komponenter elektronegativitet af reaktanterne, dvs. mellem alkan og svovlsyre. Alkan har brint og svovlsyre, sulfongruppen.
Nedenfor har vi trin for trin mekanismen for a sulfoneringsreaktion i alkaner. Som et eksempel vil vi bruge den enkleste alkan, methan (CH4):
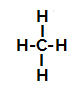
Strukturformel af metan
1. trin: Afbrydelse af bindingen mellem hydroxyl (OH) og svovl (S) i svovlsyre.
Hver hydroxylgruppe, der er til stede i svovlsyre, er karakteriseret ved at være mere elektronegativ. Ved opvarmning under reaktionen er tendensen, at bindingen mellem hydroxylgruppen og svovlet brydes:
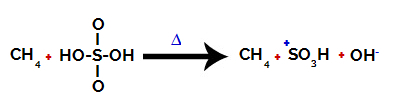
Afbrydelse af bindingen mellem svovl og hydroxyl
Bruddet på bindingen af alle hydroxyler forekommer imidlertid ikke på grund af den elektroniske omlejring i strukturen. Derefter opnås en hydroxidanion (OH).-) og en sulfonisk kation.
2. trin: Hydroxylgruppe angreb på alkanmolekylet.
Derefter hydroxygruppen (OH-) udfører et angreb på alkanen og forårsager, at bindingen mellem kulstof og brint (som er mere skrøbelig på grund af forskellen i elektronegativitet mellem dem) brydes.
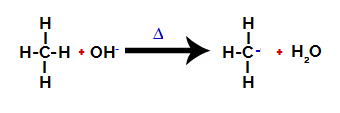
Bryde båndet mellem kulstof og brint i alkan
Bemærk: Afbrydelse af bindingen mellem kulstof og brint vil altid forekomme hyppigst på kulstof med lavere elektronisk densitet eller ladning. Jo færre hydrogen kulstof har, eller jo flere grupper der er knyttet til det, jo lavere er dets elektrondensitet. Så vi har:
Tertiært kulstof
Efter at bindingen er brudt, bliver alkanen et elektronmangel med kulstof (carbocation). Hydroxidgruppen (OH)-) interagerer med det frigivne brint og danner et vandmolekyle.
3. trin: Angreb af den dannede radikale på sulfongruppen.
Endelig angribes sulfongruppen af resten af alkanen og danner en sulfonsyre.
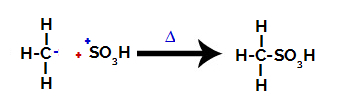
Strukturer, der interagerer og danner sulfonsyre
Eksempler på ligninger, der repræsenterer sulfoneringsreaktioner i alkaner
1. eksempel: Sulfonering af propan.
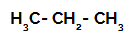
Strukturformel af propan
Propan har to primære carbonatomer og et sekundært kulstof, som har forskellige ladninger, fordi de er bundet til forskellige mængder brint. Da kulstof er mere elektronegativt end brint, har disse kulstoffer forskellige elektrondensiteter.
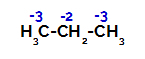
Fordeling af ladninger på hvert carbonatom i propan
På primære kulstoffer er ladningen -3 (fordi den er bundet til tre hydrogener), og på det sekundære kulstof er ladningen -2 (fordi den er bundet til to hydrogener). Således vil der være et brud i bindingen mellem kulstof og brint, undertiden ved kulstof 1 (af et molekyle), undertiden ved kulstof 2 (af et andet molekyle).
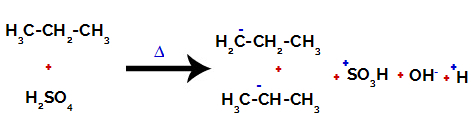
At bryde båndet mellem kulstof og brint på forskellige kulstoffer
Efter pauserne mellem bindingerne, både i svovlsyre og i alkan, er der dannelsen af produkter med erstatning af brint på kulstof 1 med en sulfongruppe, og det samme sker på kulstof 2.
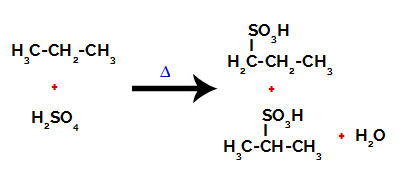
Produkter dannet ved sulfonering af propan
2. eksempel: Sulfonering af 2-methyl-butan.

Strukturformel af 2-methyl-butan
2-methyl-butan har tre primære carbonatomer, et sekundært carbon og et tertiært carbon, som har forskellige ladninger og følgelig forskellige elektroniske densiteter, som det kan ses i følgende struktur:
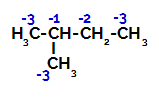
Fordeling af elektroniske ladninger i 2-methyl-butan
Derfor er der i 2-methyl-butan flere muligheder for at bryde bindingen mellem kulstof og brint, som kan forekomme på kulstof 1 (af et molekyle), kulstof 2 (af et andet molekyle), kulstof 3 eller kulstof 4. Det er dog bemærkelsesværdigt, at afbrydelsen ved kulstof nummer 2 er mere almindelig.
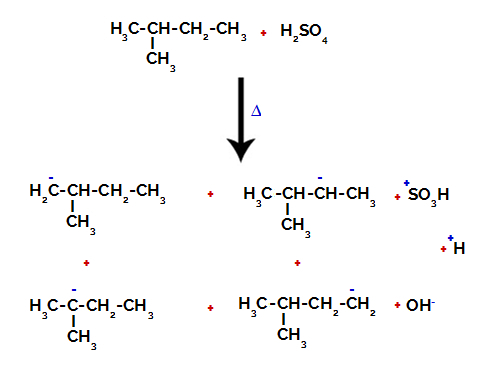
At bryde båndet mellem kulstof og brint på forskellige kulstoffer
Efter bruddet mellem bindingerne, både i svovlsyre og i alkan, dannes produkter med udskiftning af brint på kulstof 1 med en sulfongruppe, og det samme sker på kulstof 2.

Produkter dannet ved sulfonering af 2-methyl-butan
Af mig Diogo Lopes Dias
Kilde: Brasilien skole - https://brasilescola.uol.com.br/quimica/reacoes-sulfonacao-alcanos.htm

