Hvis vi bruger et voltmeter i et batteri, vil vi være i stand til at identificere forskellen i potentiale (U eller ddp) eller elektromotorisk kraft (emf eller E) mellem de to elektroder. Det er imidlertid ikke muligt at identificere reduktion eller oxidationspotentialer for hver elektrode på denne måde.
Forskere havde brug for at kende disse værdier for at studere oxidationsreduktionsprocesser, så de etablerede en referencetilstand. Dette betyder, at det blev aftalt at måle potentialet for hver elektrode i forhold til en anden elektrode under følgende standardbetingelser:
• Temperaturen skal være ved 25 ° C;
• Tryk ved 1,0 atm;
• Koncentrationen af opløsningen, hvor metallet nedsænkes, skal være 1,0 mol / l.
Således var den valgte elektrode den brintelektrode, som er repræsenteret nedenfor:
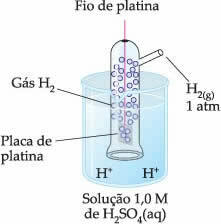
Denne elektrode er sammensat af en platinatråd, der er forbundet til en platinplade, som ikke deltager i reaktionen, inde i et rør indeholdende hydrogengas og nedsænket i en sur opløsning. I eksemplet var opløsningen svovlsyre.
| Efter konvention er standardbrintelektroden tildelt værdien nul, så meget for E0rød hvad angår E0oxy. |
For at finde den potentielle værdi af enhver anden elektrode bygger vi bare en stak af den elektrode, vi ønsker med standardbrintelektroden og måler ddp med et voltmeter. Den værdi, der vises på voltmeteret, vil være potentialet for den eftersøgte elektrode, da den for brint er lig med nul.
For eksempel forbinder vi en zinkelektrode med hydrogenelektroden for at finde ud af, hvad dens reduktionspotentiale er:
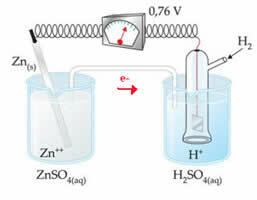
I henhold til ovenstående skema identificerede voltmeteret potentialforskellen som lig med +0,76 (? E0 = +0,76). Vi bemærker også, at zinkelektroden er oxideret, så det er anoden; og hydrogenelektroden reduceret, idet den er katoden.
Så vi har:
? E0 = E0red (katode) - E0 rød (anode)
0,76 = 0,00 - E0 rød (Zn)
E0 rød (Zn) = 0,00-0,76
E0 rød (Zn) = -0,76
Den negative værdi betyder, at elektronstrømmen strømmer fra zinkelektroden (anoden) til hydrogenelektroden og opfører sig således som en katode. Hvis det var positivt, ville det være omvendt, og hydrogenelektroden ville opføre sig som en anode. Dette kan ses, når vi forbinder en kobberelektrode med standardbrintelektroden:
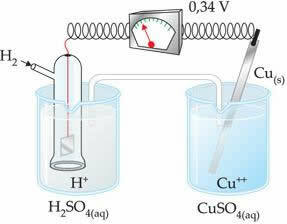
? E0 = E0red (katode) - E0 rød (anode)
-0,34 = 0,00 - E0 rød (Zn)
E0 rød (Zn) = 0,00 + 0,34
E0 rød (Zn) = +0,34
Det er således muligt at definere reduktions- og oxidationspotentialer for de mest varierede kemiske arter. International Union of Pure and Applied Chemistry (IUPAC) anbefaler dog kun anvendelse af reduktionspotentialer. Og uanset det anvendte metal, i batterirepræsentationen, kommer brintelektroden altid først, for eksempel:
Pt - H2 (g) 1 atm / H3O1 + (aq) 1 mol / L // Cu2 + (aq) 1 mol / L / Cu
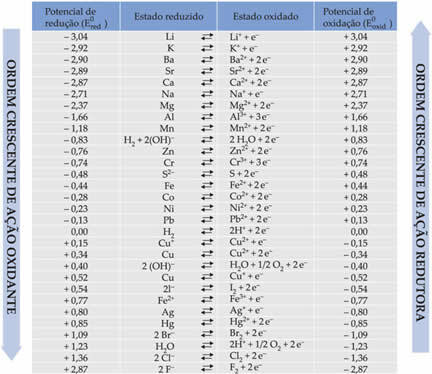
Nedenfor i tabellen er de potentialer, der opnås gennem denne metode til anvendelse af standardbrintelektroden sammen med deres respektive halvreaktioner:
Af Jennifer Fogaça
Uddannet i kemi
Brazil School Team
Kilde: Brasilien skole - https://brasilescola.uol.com.br/quimica/medicao-dos-potenciais-eletroquimicos.htm

