I teksten "Titel eller masseprocent”Vi så, hvordan man beregner forholdet mellem massen af det opløste stof og massen af opløsningen for faste, flydende og gasformige opløsninger. I denne tekst vil vi dog se, at det også er muligt at beregne titeren udtrykt i volumen for opløsninger med flydende eller gasformige komponenter.

Titlen i volumen kan beregnes ved hjælp af udtrykket:
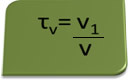
Overvej som et eksempel en vandig opløsning af ethylalkohol anvendt som et antiseptisk og desinfektionsmiddel, hvilket var fremstillet ved tilsætning af 70 ml ren alkohol til nok vand til at fylde op til et volumen på 100 ml opløsning. Så vi har:
τ = 70 ml = 0,7
100 ml
Vi kan også udtrykke titlen i procent ved blot at multiplicere resultatet med 100%. Så i dette tilfælde har vi en 70% ethylalkoholopløsning, hvilket betyder, at ud af hver 100 volumen enheder af opløsningen er 70 volumen enheder alkohol.
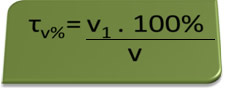
I nedenstående tilfælde har vi en 70% ethylalkoholopløsning i et 250 ml volumen opløsning; hvilket betyder, at 175 ml er alkohol ifølge beregningerne:
100 ml 70 ml alkohol
250 ml x
x = 70. 250
100
X = 175 ml alkohol

Vi kan dog ikke sige, at vi i dette tilfælde har 75 ml (250-175) vand. I modsætning til massetiter, hvor vi kan tilføje opløsningsmidlets masse til opløsningsmassens masse for at finde opløsningsmassen, kan dette ikke gøres i forhold til volumen-titeren.

Dette betyder, at opløsningsvolumenet ikke er lig med summen af opløsningsmiddelvolumenet og det opløste volumen (selvom forskellen ofte kan betragtes som ubetydelig). Dette skyldes, at de intermolekylære kræfter, der findes i disse væsker, påvirker det endelige volumen.
I tilfældet med den førnævnte opløsning af ethylalkohol, for eksempel når vi blander alkohol med vand, er der en sammentrækning af det samlede volumen af opløsningen; det vil sige, at det endelige volumen vil være mindre, end hvis vi tilføjede mængden af alkohol og vand alene. Dette skyldes, at alkoholmolekylerne etablerer bindinger eller hydrogenbindinger med vandmolekylerne, hvilket reducerer mellemrummet mellem dem.
Derfor skal volumenet af opløsningen i dette og andre tilfælde måles eksperimentelt, når det ikke er angivet i øvelsen.
Volumenprocenten anvendes i vid udstrækning i tilfælde af alkoholholdige drikkevarer og kommerciel alkohol, som nævnt ovenfor. Se to vigtige anvendelser af denne beregning:
- Åndedrætsværn: åndedrætsværn måler koncentrationen af ethylalkohol i blodet, og i Brasilien er det forbudt for nogen at køre nogen form for køretøj med et blodalkoholindhold på 0,1 volumenprocent eller derover. En person med dette alkoholindhold har for hver liter blod 1 ml alkohol som vist ved følgende beregninger:
τv%=V1. 100%
v
0,1 % = V1. 100%
1L
V1 = 0,1% → V1 = 0,001 L = 1 ml
100%

- Ethanolindhold i benzin: i Brasilien reguleres benzin ved tilsætning af ethanol. Men ethanolindholdet i benzin skal højst være 24 volumen% vandfri alkohol (da benzin skal være vandfri). Jo mere ethanol tilsættes benzin, jo mere bliver brændstoffets farve lysere, og dens densitet øges.
Af Jennifer Fogaça
Uddannet i kemi
Kilde: Brasilien skole - https://brasilescola.uol.com.br/quimica/titulo-volume-uma-solucao-quimica.htm

