Da der er tusindvis af organiske forbindelser, kan fænomenet isomerisme antage flere former. Derfor kan isomerisme grundlæggende klassificeres i to typer: flad eller forfatningsmæssig isomerisme og rumisomerisme eller stereoisomerisme. Hver nævnte type kan opdeles som vist i følgende diagram:
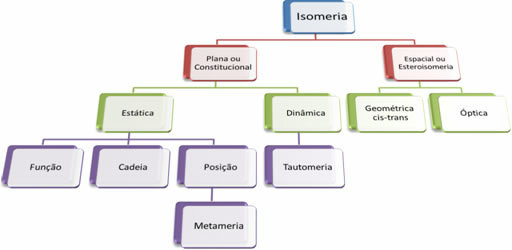
Se hvert tilfælde:
1. Flad eller forfatningsmæssig isomerisme: Isomerer af denne type har den samme molekylære formel og adskiller sig ved flade strukturformler. Der er fem tilfælde af planisomerisme: funktion, kæde, position, metamerisme og tautomerisme.
1.1.Funktionel eller funktionel isomerisme: Forskellen mellem isomererne er i den funktionelle gruppe.
Eksempel: Molekylær formel C3H6O
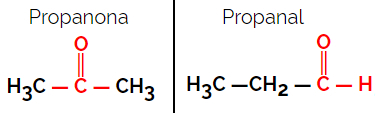
Bemærk, at propanon er fra ketongruppen, og propanal er fra aldehydgruppen.
1.2. Kæde- eller skeletisomerer: Forskellen mellem isomererne er i typen af kæde. For eksempel er en isomer åben kæde og den anden lukket kæde, eller den ene er normalkæde og den anden forgrenet kæde, eller den ene er en homogen kæde, og den anden er en heterogen kæde.
Eksempel: Molekylær formel C4H10
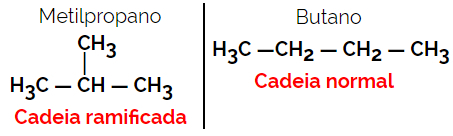
1.3.Positional eller positionel isomerisme: Forskellen er i positionen for en umættethed, en funktionel gruppe, et heteroatom eller en substituent.
Eksempel: Molekylær formel C4H6

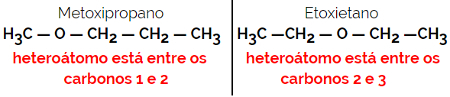
1.4.Kompensationsisomerisme eller metameri: Det er en særlig type positionisomerisme, hvor forskellen er placeringen af heteroatom.
Eksempel: Molekylær formel C4H10O
1.5.Dynamisk isomery eller tautomery: Det er en særlig type funktionsisomerisme, hvor isomerer eksisterer sammen i dynamisk ligevægt i opløsning. De to hovedtyper af tautomeri er mellem en keton og en enol (ketoenolbalance) og mellem et aldehyd og en enol (aldoenolbalance).
Eksempel: Molekylær formel C3H6O
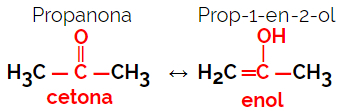
2. Rumisomerisme eller steroisomerisme: I dette tilfælde kan forskellen mellem isomerer kun visualiseres gennem orienteringen af deres atomer i rummet. Der er to typer stereoisomerisme: geometrisk isomerisme og optisk isomerisme.
2.1.Geometriske eller cis-trans-isomerer: Forskellen er, at isomeren navngives som cis den har de samme carbonligander i en dobbeltbinding eller i cykliske forbindelser på samme side af planet. Isomerliganderne trans er på modsatte sider.
Eksempel: Molekylær formel C2H2Cl2

Disse forbindelser kaldes stereoisomerer.
2.2.Optisk isomer: Opstår, når isomerer er i stand til at afbøje en polariseret lysstråle. Hvis den bøjer den polariserede lysstråle til venstre, er den en levorotær isomer, men hvis den bøjes til højre kaldes den en højrehåndet isomer.
Eksempel:
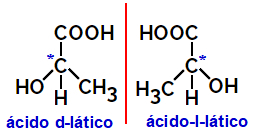
Asymmetriske molekyler som dem, der er vist ovenfor, som er spejlbilleder af hinanden og som ikke er overlejrede, kaldes enantiomerer.
Af Jennifer Fogaça
Uddannet i kemi
Kilde: Brasilien skole - https://brasilescola.uol.com.br/quimica/tipos-isomeria.htm

