Dissociation af baser det er en fysisk proces der forekommer med denne vigtige gruppe af uorganiske stoffer, når de opløses i vand, eller når de gennemgår fusionsprocessen (passage fra fast tilstand til flydende tilstand igennem opvarmning).
Generelt er fænomenet base dissociation det er frigivelsen af kationer og anioner, der danner ionisk forbindelse, som i dette tilfælde er basen. Så i løbet af base dissociation, frigivelsen af ioner der allerede findes i forbindelsen, dvs. ingen nye ioner dannes.
Basen er dannet af et hvilket som helst metal (X), som er kationen af forbindelsen, eller af ammoniumkationen (NH-gruppen4+), bundet til hydroxidanionen (repræsenteret af OH-gruppen) som i nedenstående repræsentationer:
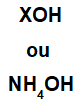
Generelle repræsentationer af en basisformel
form af repræsenterer base dissociation det gøres gennem en ligning, hvor vi i reaktanten har basen, og i produkterne har vi ioner (kationer og anioner). Hvad der gør forskellen er, hvordan dissociationen finder sted:
Opløsning af basen i vand:
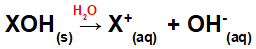
Ligning, der repræsenterer dissociationen af en base i et vandigt medium
Dissociation ved basisfusion:
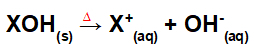
Ligning, der repræsenterer dissociationen af en base ved fusionsprocessen
Når vi analyserer de generelle ligninger ovenfor, verificerer vi, at vi i dem alle altid vil have basen, kationen (som er metallen eller NH-gruppen4+) og anionen (OH-). Men er de alle sådan? Er der ingen forskel mellem dem? For det første spørgsmål er svaret nej, og for det andet spørgsmål er svaret ja.
Når vi udfører dissociation fra en base, det er grundlæggende først at analysere basisformlen, fordi vi ud fra den kan bestemme belastningen på kation og molmængden af hydroxidanioner, da molmængden af kation er standard (altid 1 mol).
Det er værd at huske, at mængden af OH-grupper, der er til stede i basisformlen, bestemmer ladningen af kationen og mængden i mol af hydroxidanionen i dissociationen af basen.
Lad os se på eksemplerne på aluminiumhydroxid [Al (OH)3] og guldhydroxid (AuOH). I aluminiumbaseformlen er der tre OH-grupper og i guldbaseformlen kun en OH-gruppe. Således har vi i dissociationen af disse baser:
Al (OH) dissociation3:
Da denne base har tre OH-grupper i formlen, vil ladningen på kationen være +3, og mængden i mol af anioner er lig med 3 mol, som vi kan se i følgende ligning:
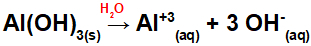
Aluminiumbasis dissociationsligning i vandigt medium
Dissociation fra AuOH:
Da denne base har en OH-gruppe i formlen, vil ladningen på kationen være +1, og mængden i mol af anioner er lig med 1 mol, som vi kan se i følgende ligning:
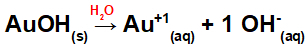
Ligning af basedissociation med guld i vandigt medium
Af mig Diogo Lopes Dias
Kilde: Brasilien skole - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-dissociacao-das-bases.htm

