entropi er en storhedtermodynamik forbundet med irreversibilitet af tilstandene i et fysisk system. Det er almindeligt forbundet med graden af "sygdom”Eller“tilfældighed”Af et system. Ifølge et af udsagnene fra 2. lov om termodynamik:
“I et termisk isoleret system skal måling af entropi altid øges over tid, indtil den når sin maksimale værdi. ”
Med andre ord, entropi er i stand til at måle betydningen af "tidens pil”Af et system. Når vi ser billederne nedenfor, ved vi intuitivt, at systemets starttilstand er repræsenteret af billedet af venstreaf de største organisation:
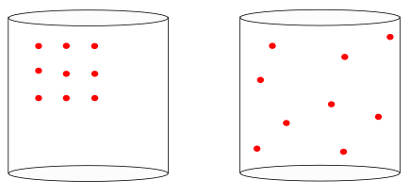
Når man ser på det forrige billede, ved vi, at den mest sandsynlige endelige konfiguration er den, atomer har hastigheder i alle retninger, såvel som tilfældige positioner. Det er hvad entropi handler om: a mangfoldighed af tilstande i et system skal altid øges.
Eksempler
Hvilke af nedenstående indstillinger er mere sandsynligt skal overholdes for et arrangement af mursten over tid?

I den første konfiguration er mangfoldighed
af tilstandene i blokke er lille: de er alle arrangeret i retningvandret, parallel hinanden. Med tiden eller handlingen fra en agent forventes det, at dens konfiguration vokse op i nummer i Stater, begunstiger Mandagkonfirmation, illustreret i billedet til højre. Andre eksempler kan gives:Når en ispose placeres i en beholder med størretemperatur, stiger temperaturen, indtil den når termisk balance. På det tidspunkt kan isen smelte. Ved at tage varmen igen fra isblokken, som nu er i staten væske, det kan blive solidt igen, men dets konformation vil ikke have den samme organisation tidligere præsenteret.
Når du åbner en flaske parfume, kan varmen hjælpe diffusion af din molekyler, sprede indholdet af parfume over hele et rums længde. Det modsatte kan ikke forventes, da fjernelse af varme ikke vil fremme molekylernes tilbagevenden til kolben.
Matematisk definition af entropi
DET matematisk definition entropi er givet ved forholdet mellem mængden af varme (Q) overført mellem to dele af et termisk isoleret system, i joules (J) ved sin absolutte temperatur i Kelvin (K):

S = Entropi (J / K)
ΔQ = Varmemængde (J)
T = Absolut temperatur (K)
Ovenstående definition gælder for isotermiske processer, det vil sige, hvor der er varmeudvekslinger så små (eller langsomme), at de ikke er i stand til at ændre systemets temperatur. Definitionen af entropi er derfor uendelig minimal (uendelig lille del).
Vi kan også forstå begrebet entropi som følger: at være et system dannet af to dele af den samme gas, i mange forskelligetemperaturer, er det muligt at udtrække en vis mængde arbejde af ham bevæger sig nogle stempel eller håndsving, for eksempel. Imidlertid, over tid, vil dele af denne gas have tendens til at balancetermisk. Hvis der ikke længere er temperaturforskel, selv med al den energi der er der, er det ikke muligt at udvinde nogen arbejdenyttig fra ham.
Af Rafael Hellerbrock
Uddannet i fysik
Kilde: Brasilien skole - https://brasilescola.uol.com.br/o-que-e/fisica/o-que-e-entropia.htm
