diffusion og effusion er to love, der er foreslået af den skotske kemiker Thomas Graham i det 19. århundrede, baseret på hans studier om gasblandinger og opførsel af gasser når du går gennem væggene i en container.
Blandt de observationer, som Thomas Graham har gjort med hensyn til gassernes opførsel i forhold til diffusion og effusion, kan vi fremhæve følgende:
En gas har altid en tendens til at passere gennem små huller til stede i faststofmateriale;
Jo større molekylmasse jo større er dens vanskelighed ved at passere gennem hullerne i fast stof;
Jo lavere densiteten af gassen er, desto større er dens bevægelseshastighed;
Jo højere temperaturen en gas udsættes for, jo større er den hastighed, hvormed den spreder sig i omgivelserne eller passerer gennem en åbning;
- En gas forbliver aldrig statisk et bestemt sted.
Diffusion
Diffusion det er et fysisk fænomen, der består i en gas evne til at diffundere (det vil sige at sprede sig) gennem et områdes rum eller inde i en container. Af denne grund kan vi sige, at en gas i et rum aldrig er begrænset til et enkelt sted.

Repræsentation af forekomsten af en udsendelse
Derudover kan vi definere diffusion stadig som den kapacitet, som en gas har til at blande sig med en anden, når den placeres i den samme beholder og danner en homogen gasformig blanding.
Et eksempel er når gasser kommer ud af køretøjets udstødning. Så giftige som de er, forårsager de ikke kortsigtede skader på mennesker, da de spredes gennem den atmosfæriske luft, hvilket reducerer deres koncentration.
Effusion
Effusion det er et fysisk fænomen, der består i passage af en gas gennem huller, der findes i væggene i en bestemt beholder, dvs. den består i udgangen af en gas fra et miljø til et andet.

Repræsentation af forekomsten af en udgydelse
Et eksempel er, når ballonerne pustes op til en fest, og den næste dag tømmes de alle sammen, alt sammen fordi luften slipper ud gennem hullerne i ballonerne.
Beregninger relateret til diffusion og effusion
Vi kan beregne, ifølge ligninger foreslået af Graham, den hastighed, hvormed en gas udfører diffusion eller effusion. Ifølge Graham er diffusions- og effusionshastighederne for to gasser blandet i en beholder altid omvendt proportional med kvadratet af deres relative densitet eller deres molære masse.
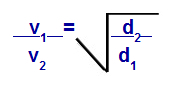
Grahams lov med hensyn til tæthed
v1 = hastighed (effusion eller diffusion) af gas 1 i blandingen;
v2 = hastighed (effusion eller diffusion) af gassen 2 i blandingen;
d1 = densitet af gas 1 af blandingen;
d2 = massefylde af gas 2 i blandingen;
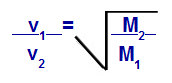
Grahams lov om molarmasse
v1 = hastighed (effusion eller diffusion) af gas 1 i blandingen;
v2 = hastighed (effusion eller diffusion) af gassen 2 i blandingen;
M1 = molær masse af gas 1 af blandingen;
M2 = molær gasmasse 2 i blandingen.
Af mig. Diogo Lopes Dias
Kilde: Brasilien skole - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-difusao-efusao.htm

