I en isoterm transformation er den volumen og trykvariation af en bestemt gas, men konstant temperatur; deraf oprindelsen til det isotermiske navn (græsk: iso = lig; termo = varme).
Forskere Boyle og Mariotte udførte isoleret lignende eksperimenter, og det opnåede resultat var: når trykket stiger, falder gasens volumen.
Tænk for eksempel på stemplet i en sprøjte. Hvis vi anvender eksternt tryk på dette stempel, det vil sige, hvis vi øger trykket, vil volumenet af luft optaget inde i sprøjten falde og omvendt.
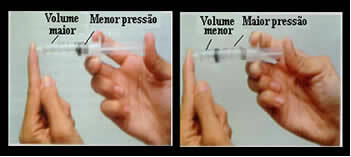
Volumen og tryk er omvendt proportionalt: i venstre boks er trykket lille, og volumen optaget af luft er stort. Til højre, når der påføres mere tryk på sprøjtestemplet, falder lydstyrken.
Dette er ikke et isoleret tilfælde, det er noget, der gentages med almindelig regelmæssighed for gasser. Derfor blev denne kendsgerning anført i form af en lov, som kan beskrives som følger:
| Boyles lov eller Boyle-Mariottes lov: Under konstant temperatur er volumenet optaget af en fast masse af en gas omvendt proportionalt med dens tryk. |
Dette betyder, at hvis vi fordobler trykket på en gas, halveres dens volumen og så videre. Når to sådanne mængder er omvendt proportionale, er deres produkt konstant; således, matematisk kan dette forhold repræsenteres som følger:
| P.V = k |
Hvor k = konstant.
Således hvis vi i en første situation har trykværdien af en bestemt gas som P1 og dens respektive volumen som V1, så er vi nødt til at:
| P1. V1 = k |
Hvis vi øger dette tryk til P2, ændres dets volumen også til V2, og igen bliver vi nødt til at:
| P2 . V2 = k |
Således når vi konklusionen:
| P1. V1 = P2. V2 |
Denne konstans kan ses ved eksemplet i nedenstående tabel med tryk og volumener af en gas med en fast masse:
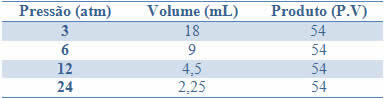
Ved at tegne disse værdier, ser vi dannelsen af en kurve.
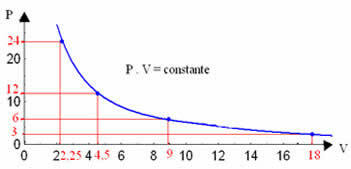
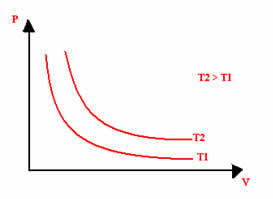
Den grafiske repræsentation af en isoterm transformation vil altid være en hyperbol uanset værdierne for tryk og volumen og temperatur, hvor eksperimentet blev udført. Denne hyperbola kaldes isoterm; så som det kan ses i nedenstående graf, giver forskellige temperaturer forskellige isotermer.
Kilde: Brasilien skole - https://brasilescola.uol.com.br/quimica/transformacao-isotermica-ou-lei-boyle.htm
