EN elektrosfære er det område af atomet, hvori elektronerne De er placeret. Elektrosfæren er mere præcist sammensat af atomare orbitaler, bestemt ved at løse Schrödinger-ligningen. Først bestemt af Rutherfords model, fik elektrosfæren betydelige fremskridt under gyldigheden af Bohrs atommodel.
Elektrosfæren kan opdeles i lag (eller energiniveauer), da elektroner har defineret (ikke-kontinuerlig) energi. For atomer med to eller flere elektroner opdeles skallerne i underskaller (eller underskaller). Elektrosfæren er ekstremt vigtig for at forstå atomets egenskaber og forstå dannelsen af kemiske bindinger.
Læs også: Hvordan opdeles atomet?
Emner i denne artikel
- 1 - Sammenfatning af elektrosfæren
- 2 - Videolektion om elektrosfære
- 3 - Hvad er elektrosfæren?
- 4 - Lag af elektrosfæren
- 5 - Elektrosfærens funktion
- 6 - Forholdet mellem elektrosfæren og atomstrukturen
- 7 - Løste øvelser på elektrosfæren
Sammenfatning om elektrosfæren
Elektrosfæren er det område af atomet, hvor elektroner er placeret.
Det er sammensat af atomare orbitaler, bølgefunktioner, der er løsninger på Schrödingers ligninger.
Dens koncept begyndte med modellen af Ernest Rutherford.
Elektroner holdes i elektrosfæren på grund af deres tiltrækning til atomkernen.
De vigtigste fremskridt i forståelsen af elektrosfæren skete under udformningen af Niels Bohrs model.
Det er sammensat af lag (eller energiniveauer), som er områder med defineret energi.
For atomer med mere end én elektron opdeles skallerne i underskaller (eller underskaller).
Elektrosfæren er vigtig for at forstå flere egenskaber, såsom atomart lighed, stabilitet, atomradius, ioniseringsenergi, elektronaffinitet, ud over at forstå dannelsen af bindinger kemikalier.
Video lektion om elektrosfære
Hvad er elektrosfæren?
Elektrosfæren er defineret som det område af atomstrukturen, hvori elektroner er placeret. I mere dybtgående fortolkninger siger vi, at det er sammensat af atomare orbitaler, bølgefunktioner, der er løsninger på Schrödingers ligning. Det matematiske udtryk for en atomorbital, når kvadreret, præsenterer sandsynlighedstætheden for elektronens placering ved et givet punkt.
O begrebet elektrosfære begyndte at dukke op med Ernest Rutherfords atommodel, som har elektroner, der kredser omkring en tæt, positiv kerne. Senere bragte Niels Bohr mere betydningsfulde fortolkninger af elektrosfæren ved at blande begreber fra kvantemekanikken.
Stop ikke nu... Der er mere efter reklamen ;)
Lag af elektrosfæren
Elektroner holdes i elektrosfæren på grund af deres tiltrækning til atomkernen. Det vides dog, at disse elektroner er i skaller, hvis energier er veldefinerede. Sådanne lag kan også kaldes energiniveauer.
Denne konklusion kom efter spektroskopi-eksperimenter. For eksempel, når en elektrisk strøm påføres gas H2 Ved lavt tryk udsendes lys af H2. I denne tilstand dannes H-ioner+ og elektroner, som vil vende tilbage til H-ionerne+ og vil danne ophidsede (energigivende) arter af H+. For at lindre overskydende energi, H ioner+ frigive energi i form af elektromagnetisk stråling (lys) og rekombinere til H-gas2 en gang til.
Du husker måske, at når hvidt lys passerer gennem et prisme, nedbrydes det i et kontinuerligt spektrum (svarende til en regnbue); det samme sker dog ikke med lyset, der kommer fra H2: når sådan stråling passerer gennem prismet, observeres kun lyse linjer med en defineret bølgelængde i H-emissionsspektret2, kendt som spektrallinjer.
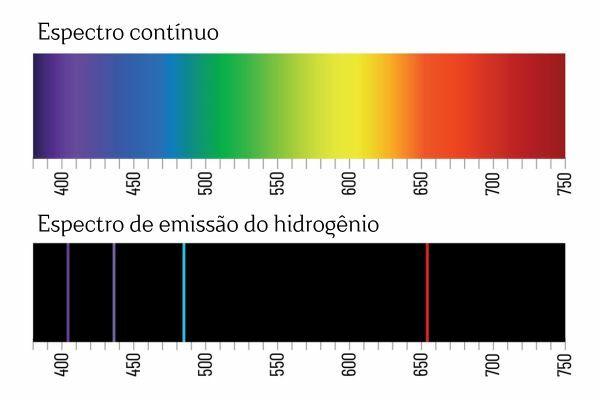
Fortolkningen for grundstoffernes emissionsspektre (med veldefinerede spektrallinjer) er den en elektron, i et atom, kan ikke præsentere nogen energi, men snarere i veldefinerede mængder (såkaldte energipakker). Hvis elektroner ikke havde sådanne energetiske begrænsninger, ville grundstoffernes emissionsspektrum være kontinuerligt, ligesom det hvide lys, der passerer gennem et prisme.
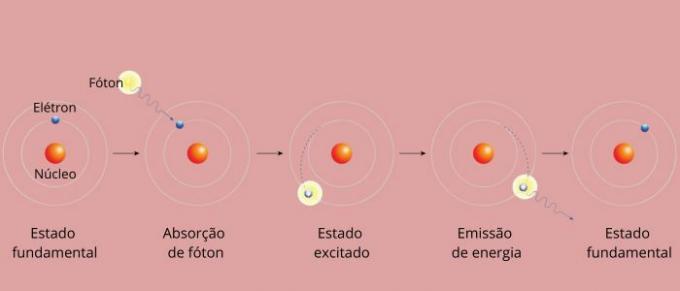
Hver spektrallinje i et grundstof blev kendt som et energiniveau. (eller lag, som vi er mere vant til at sige). Disse linjer opstår, når en elektron går fra et tilladt energiniveau til et andet, i en energiændringsproces kendt som en elektronisk overgang.
Under den elektroniske overgang går elektronen fra et lavere energiniveau til et højere energiniveau. Når den vender tilbage til sit oprindelige niveau, udsender den overskydende energi gennem elektromagnetisk stråling (lys), hvilket giver oprindelse til spektrallinjen, hvis udsendte energiværdi er proportional med en værdi defineret af ligningen for Rydberg.
Johannes Rydberg var en svensk spektroskopist, der skabte en ligning for at definere tendensen til spektrallinjer baseret på arbejdet fra den schweiziske professor Johann Balmer. Den specifikke energi af hvert lag defineres ved at løse den passende Schrödinger-ligning.
Hvert elektronisk lag har et antal tilladte elektroner. I øjeblikket er syv elektroniske lag defineret, identificeret med bogstaverne K til Q, i alfabetisk rækkefølge, eller med bogstavet n, hvor n ≥ 1. Lag K er således laget, hvor n = 1, og så videre. Antallet af tilladte elektroner pr. skal er vist i følgende tabel.
Energiniveau |
Lag |
Maksimalt antal elektroner |
1 |
K |
2 |
2 |
L |
8 |
3 |
M |
18 |
4 |
N |
32 |
5 |
O |
32 |
6 |
P |
18 |
7 |
Q |
8 |
For hydrogenoide atomer (med kun 1 elektron, såsom H, He+, Li2+), alle atomare orbitaler har den samme energi (vi kalder dem degenererede orbitaler); i atomer med to eller flere elektroner opstår der dog en meget vigtig effekt, elektron-elektron frastødning. Konsekvensen af dette faktum er, at hvert lags orbitaler begynder at have forskellige energier, og derfor begynder lagene at blive beskrevet som underlag (eller underniveauer).
For nuværende atomer kan hvert lag dekomponeres i op til fire underniveauer, repræsenteret ved bogstaverne "s" (fra engelsk, skarp), "p" (fra engelsk, vigtigste), "d" (fra engelsk, diffuse) og "f" (fra engelsk, grundlæggende).
Hvert underniveau understøtter et maksimalt antal elektroner, defineret ved beregninger og eksperimenter. "s" underniveauet understøtter op til 2 elektroner; "p" underniveauet, op til 6 elektroner; "d" underniveauet, op til 10 elektroner; og "f"-underniveauet, op til 14 elektroner. K-laget er det eneste, der kun tillader en enkelt orbital og har derfor kun et enkelt underniveau.
Energiniveau |
Lag |
Underniveauer |
1 |
K |
1s |
2 |
L |
2s, 2p |
3 |
M |
3s, 3p, 3d |
4 |
N |
4s, 4p, 4d, 4f |
5 |
O |
5s, 5p, 5d, 5f |
6 |
P |
6s, 6p, 6d |
7 |
Q |
7s, 7p |
Elektrosfærens funktion
Hvert atoms elektrosfære kan bruges til at forklare atomets forskellige egenskaber og adfærd.
Egenskaber som atomradius, ionradius, ioniseringsenergi og elektronaffinitet har værdier, der er en direkte konsekvens af den elektroniske konfiguration af elektrosfæren, mere specifikt kaldet valensskal, som faktisk er den yderste besatte elektroniske skal af et atom eller ion.
EN lighed mellem atomer fra samme gruppe i det periodiske system er også en konsekvens af den elektroniske konfiguration af valensskallen. I kemiske processer vælger vi atomer fra samme gruppe i det periodiske system som muligt substituenter, og dette er kun plausibelt, da disse atomer har den samme elektroniske konfiguration i laget af valens.
Til kemiske bindinger, som opstår mellem atomer for at danne ioniske og kovalente forbindelser (molekyler), forekommer også gennem interaktioner mellem atomernes elektrosfærer.
Læs også: Schrödingers atommodel - måde at beskrive atomet ved hjælp af kvantemekanik
Forholdet mellem elektrosfæren og atomstrukturen
Som nævnt omfatter elektrosfæren området af atomet, hvor elektroner kan findes. Elektroner er mere specifikt placeret i atomare orbitaler, som har energi defineret ved kvanteberegninger.
Elektrosfæren er den største region i atomstrukturen, da kernen i et atom er meget lille. Hvis man tænker på atomet som et fodboldstadion, ville kernen svare til en bold i midten af banen, mens resten af stadionet ville være elektrosfæren.
Ikke desto mindre, i form af masse bidrager elektrosfæren kun lidt. Da massen af elektroner er omkring 1836 gange mindre end protoner og neutroner, kan vi sige, at næsten hele atomets masse er koncentreret i kernen.
Løste øvelser på elektrosfæren
Spørgsmål 1
(Facisb 2023) I Bohrs model for brintatomet kan elektronen kun optage bestemte baner. Nogle af disse baner er repræsenteret i figuren, hvor n refererer til de energiniveauer, som elektronen har i hver bane.
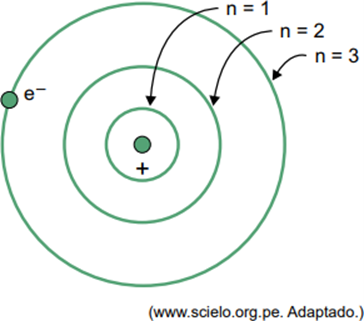
Overvej, at i et brintatom er elektronen i kredsløbet, hvor n = 5.
Ifølge Bohr-modellen vil denne elektron kun udsende energi i form af elektromagnetisk stråling, når
(A) lav en overgang til kredsløbet, hvor n er lig med 6.
(B) forbliv i kredsløbet, hvor n = 5.
(C) overgang til enhver bane, hvor n er større end 5.
(D) overgang til enhver bane, hvor n er mindre end 5.
(E) udstødes fra atomet og ioniserer det.
Svar: Bogstav D
Når en elektron er i en ydre skal, når den vender tilbage til en indre skal med lavere energi, frigiver den overskydende energi i form af elektromagnetisk stråling (lys). Derfor vil forekomsten af lys kun forekomme, når elektronen til stede i n = 5 laver en overgang til en indre skal.
Spørgsmål 2
(Uerj 2019) For nylig lykkedes det forskerne at producere metallisk brint ved at komprimere molekylært brint under højt tryk. De metalliske egenskaber for dette grundstof er de samme som de andre grundstoffer i gruppe 1 i det periodiske klassifikationstabel.
Denne lighed er relateret til det mest energiske underniveau af disse elementer, hvilket svarer til:
(A) ns1
(B) n.p.2
(C) na3
(D) nf4
Svar: Bogstav A
Brintatomet har kun en enkelt elektron, som er placeret i første niveau, underniveau "s" (1s1). En grund til, at det findes i gruppe 1 i det periodiske system, er fordi alle andre kemiske grundstoffer i denne gruppe har atomer, hvis valensskal er af samme type (ns)1). På grund af et lignende valenslag var hydrogen derfor i stand til at blive produceret i denne metalliske form.
Kilder:
DO CANTO, E. L.; LEITE, L. L. W.; CANTO, L. W. Kemi – i hverdagen. 1. udg. São Paulo: Moderna, 2021.
ATKINS, P.; JONES, L.; LAVERMAN, L. Principper for kemi: At stille spørgsmålstegn ved liv og miljø. 7. udg. Porto Alegre: Bookman, 2018.
ATKINS, P.; DE PAULA, J.; KEELER, J. Atkins' fysiske kemi. 11 udg. Oxford: Oxford University Press, 2018.
Vil du referere til denne tekst i et skole- eller akademisk arbejde? Se:
NOVAIS, Stéfano Araújo. "Elektrosfære"; Brasilien skole. Tilgængelig i: https://brasilescola.uol.com.br/quimica/eletrosfera.htm. Tilgået den 10. november 2023.