Det kan vi bemærke hver gang vi øger koncentrationen af en eller alle de reaktanter, der deltager i en kemisk reaktion, er der en stigning i dens udviklingshastighed, det vil sige reaktionshastigheden.
Det modsatte gælder også. For eksempel anbefales det i øjeblikket, at vi bruger alkoholgel i stedet for almindelig alkohol, da der er mindre risiko for, at det forbrænder og dermed undgår ulykker. Almindelig flydende alkohol er faktisk en blanding af alkohol og vand med gelalkohol indeholdende en mindre mængde alkohol. Når koncentrationen af en af forbrændingsreaktanterne reduceres, i tilfælde af alkohol, fortsætter reaktionen derfor langsommere. På den anden side, jo renere alkohol, jo hurtigere forbrændingsreaktion.

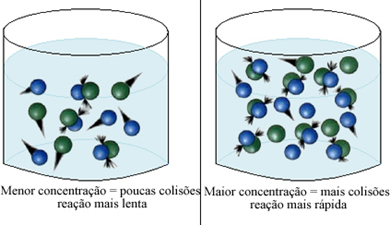
Som anført i teksten Betingelser for forekomst af kemiske reaktioner, er en af betingelserne for en reaktion at finde sted effektiv kollision mellem partiklerne. Dermed, stigningen i koncentrationen af reagenser gør det muligt at have en større mængde partikler eller molekyler begrænset i det samme rum. Dette øger mængden af kollisioner imellem dem og øger også sandsynligheden for, at der opstår effektive kollisioner, der vil resultere i reaktionen. Resultatet er, at reaktionen finder sted hurtigere.
For at se dette skal du tænke på følgende eksempel: Når vi har en brændende glød, og vi ønsker, at denne forbrænding skal behandles hurtigere, blæser vi eller blæser vi gløden? Hvorfor fungerer dette?
En af reaktanterne i denne forbrændingsreaktion er ilt i luften. Når vi ryster, fjerner luftstrømmen asken, der dannes under forbrændingen, og dette letter iltkontakten med gløden. På denne måde øger vi kontakten mellem reaktanterne og fremskynder forbrændingsreaktionen.
Kort fortalt har vi:

Når man arbejder med gasser, er en måde at øge koncentrationen af reaktanter på sænk trykket. Når vi gør dette, reducerer vi lydstyrken, og der er derfor en stigning i reagenskoncentrationer.

Af Jennifer Fogaça
Uddannet i kemi
Kilde: Brasilien skole - https://brasilescola.uol.com.br/quimica/concentracao-dos-reagentes-velocidade-das-reacoes.htm

