EN termodynamikkens anden lov dikterer, hvilke betingelser der er for varme omdannes til arbejde i varmemotorer og køleskabe. Den omhandler også definitionen af entropi som et fænomen, der er i stand til at måle desorganiseringen af partikler i fysiske systemer.
Læs også: Kalorimetri - den gren af fysik, der studerer varmeudveksling
Emner i denne artikel
- 1 - Sammenfatning af termodynamikkens anden lov
- 2 - Hvad er termodynamikkens anden lov?
-
3 - Anvendelser af termodynamikkens anden lov
- Anden lov om termodynamik i varmemotorer
- Anden lov om termodynamik i køleskabe
- 4 - Entropi og termodynamikkens anden lov
-
5 - Formler for termodynamikkens anden lov
- Termiske maskiner og køleskabe
- Køleskabe
- Eksempler på anvendelse af formler
- 6 - Carnot-cyklus
- 7 - Termodynamikkens love
- 8 - Løste øvelser om termodynamikkens anden lov
Sammenfatning af termodynamikkens anden lov
Termodynamikkens anden lov er repræsenteret af Clausius- og Kelvin-Planck-udsagn.
Clausius-erklæringen omhandler varmestrømmen fra den varmere krop til den koldere krop.
Kelvin-Planck-erklæringen adresserer termiske enheders manglende evne til at omdanne al deres varme til arbejde.
Termodynamikkens anden lov anvendes på varmemotorer og køleskabe.
Carnot-cyklussen er den maksimale effektivitetscyklus opnået af varmemotorer.
Carnot-cyklussen har fire trin, en reversibel isotermisk ekspansion, en reversibel adiabatisk ekspansion, en reversibel isotermisk kompression og en reversibel adiabatisk kompression.
Carnots sætning henviser til udbyttet af Carnot maskiner.
Hvad er termodynamikkens anden lov?
Termodynamikkens anden lov er en lov, der adresserer de begrænsninger, der opstår i termodynamiske processer. Det blev udtalt af fysikerne Rudolf Clausius (1822-1888), Lord Kelvin (1824-1907) og Max Planck (1858-1947), som vi vil se nedenfor:
Fysikeren og matematikeren Rudolf Clausius udtalte, at ledningsstrømmen af varme sker fra det højere temperaturlegeme til det lavere temperaturlegeme. lavere temperatur, derfor er det ikke naturligt, at den omvendte proces forekommer, derfor er det nødvendigt at udføre arbejde på dette system. Med det udtalte han:
Det er umuligt at gennemføre en proces, hvis eneste effekt er at overføre varme fra et koldere legeme til et varmere legeme.|1|
Den matematiske fysiker William Thomson, kendt som Lord Kelvin, sammen med bidragene fra fysikeren Max Planck, anførte umuligheden af termiske enheder med en effektivitet på 100 %, da der altid vil være varmetab.
Stop ikke nu... Der er mere efter reklamen ;)
Anvendelser af termodynamikkens anden lov
Termodynamikkens anden lov anvendes på varmemotorer og køleskabe.
Anden lov om termodynamik i maskiner termisk
Til Termiske maskiner er i stand til at omdanne varme til arbejde. En varm kilde leverer varme til varmemotoren, som gør den til arbejde. Resten af varmen sender den til den kolde kilde, som vist på billedet nedenfor:
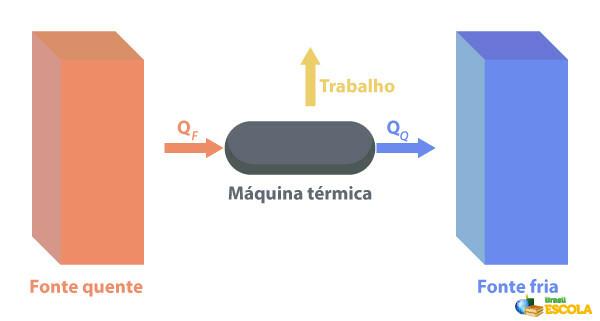
Nogle eksempler på termiske maskiner er: damp- og petroleumsturbiner i jetfly, forbrændingsmotorer, termonukleare reaktorer.
Anden lov om termodynamik i køleskabe
Køleskabe er maskiner, der De virker på den modsatte måde til at opvarme motorer., hvor de fjerner varme fra en region med temperatur lavere temperatur og levere den til et område med en højere temperatur. Da dette ikke er naturligt, er det nødvendigt for maskinen at udføre arbejde ved hjælp af elektrisk energi, som beskrevet på billedet nedenfor:
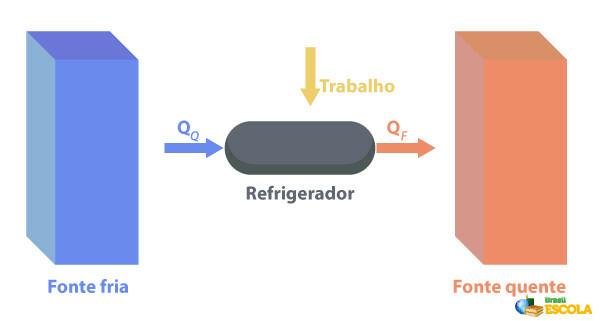
Nogle eksempler på køleskabe er køleskabe og klimaanlæg.
Entropi og termodynamikkens anden lov
EN termodynamikkens anden lov foreslår eksistensen af entropi, en fysisk mængde ansvarlig for at måle graden af desorganisering af partikler i et fysisk system eller graden af irreversibilitet af termodynamiske processer involveret i varmemotorer, er en spontan, uundgåelig, irreversibel og ekspansiv. Hermed er det kun muligt at observere og indeholde graden af volatilitet af processerne. Efterhånden som entropien øges, øges graden af uorden i systemet også.
EN Entropi nomenklatur er af græsk oprindelse og betyder "transformation"., "ændre", således at blive brugt i Fysisk for at indikere tilfældighed og uorden. Entropi kan beregnes ved hjælp af formlen:
\(∆S=\frac{∆U}T\)
\(∆S\) er entropiændringen, målt i [J/K].
\(∆U\) er ændringen i indre energi, målt i Joule [J].
T er temperaturen, målt i Kelvin [K].
Fra et statistisk synspunkt beregnes entropi ved formlen:
\(S=k\cdot ln\ Ω\)
S er entropien, målt i [J/K].
k er Boltzmann-konstanten, det er værd \(1,4\cdot 10^{-23}\ J/K\).
Ω er antallet af mulige mikrotilstande for systemet.
Læs også: Varmeudbredelsesprocesser
Formler for termodynamikkens anden lov
Termiske maskiner og køleskabe
\(Q_Q=W+Q_F\)
\(Q_Q\) er varmen fra den varme kilde, målt i Joule [J].
W er det arbejde, der udføres af varmemotoren, målt i Joule [J].
\(Q_F\) er varmen fra den kolde kilde, målt i Joule [J].
Det kan repræsenteres af:
\(W=Q_Q-Q_F\)
W er det arbejde, der udføres af varmemotoren, målt i Joule [J].
\(Q_Q\) er varmen fra den varme kilde, målt i Joule [J].
\(Q_F\) er varmen fra den kolde kilde, målt i Joule [J].
Køleskabe
\(η=\frac{Q_F}{Q_Q-Q_F}\)
\(η\) er effektiviteten af køleskabet.
\(Q_F\) er varmen fra den kolde kilde, målt i Joule [J].
\(Q_Q\) er varmen fra den varme kilde, målt i Joule [J].
Det kan repræsenteres som:
\(η=\frac{Q_F}W\)
\(η\) er effektiviteten af køleskabet.
\(Q_F\) er varmen fra den kolde kilde, målt i Joule [J].
W er det arbejde, der udføres af varmemotoren, målt i Joule [J].
Eksempler anvendelse af formler
Eksempel 1: Beregn det arbejde, som en varmemotor udfører under en cyklus, der modtager 500 J varme fra den varme kilde og kun overfører 400 J varme til den kolde kilde.
For at beregne arbejdet i en varmemotor bruger vi formlen:
\(W=Q_Q-Q_F\)
Erstatning af værdierne angivet i erklæringen:
\(W=500-400\)
\(W=100\ J\)
Varmemotorens arbejde var 100 Joule.
Eksempel 2: Hvad er effektiviteten af et køleskab, der modtager 150 J varme fra den varme kilde og overfører 50 J varme til den kolde kilde?
For at beregne effektiviteten af et køleskab bruger vi formlen:
\(η=\frac{Q_F}{Q_Q-Q_F}\)
Ved at erstatte værdierne i erklæringen får vi:
\(η=\frac{50}{150-50}\)
\(η=\frac{50}{100}\)
\(η=0,5\)
Multiplicer udbyttet med 100 %:
\(η=0,5\cdot100%\)
\(η=50\%\)
Køleskabet har en virkningsgrad på 50 %.
Carnot cyklus
Carnot-cyklussen var udviklet af videnskabsmanden Sadi Carnot (1796-1832), med det formål at identificere den maksimale effektivitet, der kan opnås af en termisk motor, der arbejder mellem en varm kilde og en kold kilde.
Baseret på sine undersøgelser identificerede Carnot, at det er det for at opnå den maksimale effektivitet fra en varmemotor nødvendigt for, at hans proces er reversibel, så han udviklede den maksimale udbyttecyklus kaldet cyklussen af Carnot og Varmemotoren, der arbejder igennem den, kaldes en Carnot varmemotor.. Da Carnot-cyklussen er reversibel, kan den vendes, hvilket er hvordan køleskabe blev udviklet.
Carnot-cyklussen, uanset det anvendte stof, er sammensat af fire processer, der er beskrevet i grafen for tryk efter volumen (p×V), som vi kan se på billedet nedenfor:
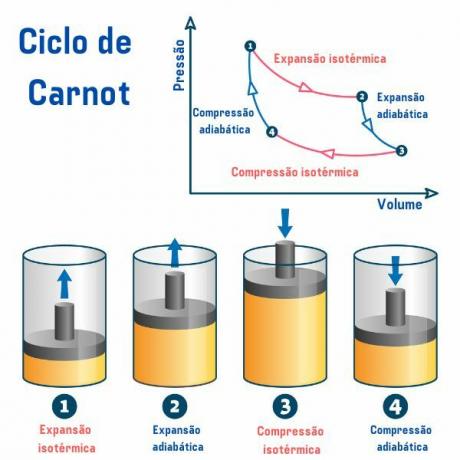
1. proces, fra punkt 1 → 2: der er en reversibel isotermisk ekspansion (proces, hvor temperaturen forbliver konstant), hvor gassen (eller systemet) virker og henter en mængde varme fra den varme kilde.
2. proces, fra punkt 2 → 3: der er en adiabatisk ekspansion (proces, hvor der er varmeudveksling med det ydre miljø) reversibel, hvor der ikke er nogen varmeudveksling varme med termiske kilder, men gassen virker, og der er et fald i dens indre energi, hvilket forårsager et fald i temperatur.
3. proces, fra punkt 3 → 4: der opstår en reversibel isotermisk kompression, hvor gassen får arbejde og afgiver en mængde varme til den kolde kilde.
4. proces, fra punkt 4 → 1: der opstår en reversibel adibatisk kompression, hvor der ikke sker varmeudveksling med de termiske kilder, og gassen er opvarmes, indtil den når temperaturen af den varme kilde, og dermed placeres i kontakt med den, afslutter cyklus.
termodynamikkens love
Termodynamikkens love er fire love, der styrer hele studiet af termodynamik, studere sammenhænge mellem volumen, temperatur og tryk og andre fysiske størrelser, såsom varme og energi.
Termodynamikkens nulte lov: er loven om termisk balance, studerer den udvekslingen af varme mellem legemer, der har forskellige temperaturer.
termodynamikkens første lov: er loven om bevarelse af energi i termodynamiske systemer, den studerer omdannelsen af varme til arbejde og/eller intern energi.
Termodynamikkens anden lov: det er loven, der omhandler varmemotorer, køleskabe og entropi.
Termodynamikkens tredje lov: er loven om absolut nul, studerer hun virkningerne af denne temperatur.
Læs også: Ydeevne af varmemotorer
Løste øvelser om termodynamikkens anden lov
Spørgsmål 1 Bestem temperaturen på den varme kilde i en Carnot-motor, vel vidende at temperaturen på den kolde kilde er 450 K og dens effektivitet er 80%.
a) 2250K
b) 450.000
c) 1500K
d) 900.000
e) 3640K
Løsning:
Alternativ A. Vi vil beregne temperaturen på den varme kilde baseret på effektivitetsformlen for en Carnot-motor:
\(η=1-\frac{T_F}{T_Q} \)
\(80 \%=1-\frac{450}{T_Q} \)
\(\frac{80}{100}=1-\frac{450}{T_Q} \)
\(0,8=1-\frac{450}{T_Q} \)
\(0,8-1=-\frac{450}{T_Q} \)
\(-0,2=-\frac{450}{T_Q} \)
\(0,2=\frac{450}{T_Q} \)
\(T_Q=\frac{450}{0,2}\)
\(T_Q=2250\ K\)
spørgsmål 2 (Cefet-PR) Termodynamikkens 2. princip kan formuleres som følger: ”Det er umuligt at bygge en maskine termisk energi, der fungerer i cyklusser, hvis eneste effekt er at fjerne varme fra en kilde og omdanne den integreret til arbejde". I forlængelse heraf fører dette princip os til at konkludere, at:
a) Det er altid muligt at bygge termiske maskiner, hvis effektivitet er 100 %.
b) enhver varmemotor behøver kun én varmekilde.
c) varme og arbejde er ikke homogene mængder.
d) enhver varmemotor trækker varme fra en varm kilde og afviser en del af denne varme til en kold kilde.
e) Kun med en kold kilde, der altid holdes på 0 °C, ville det være muligt for en bestemt varmemotor at omdanne varme helt til arbejde.
Løsning:
Alternativ D. Dette princip fortæller os, at det er umuligt at fjerne al varmen fra den varme kilde og overføre den til den kolde kilde.
Bemærk
|1| Grundlæggende fysikkursus: Væsker, Oscillationer og Bølger, Varme (vol. 2).
Af Pamella Raphaella Melo
Fysiklærer
Et systems entropi er intet andet end et mål for dets grad af desorganisering. Det er muligt at formulere den anden lov ud fra begrebet entropi.
Oplev den fascinerende historie om varmemotorer og deres vigtigste anvendelser.
Ved du hvad termiske maskiner, termodynamiske cyklusser og effektivitet er? Lær mere om disse vigtige termodynamiske begreber.
Få adgang til teksten og lær definitionen af termodynamikkens første lov, se hvilke formler der bruges af denne lov, og tjek løste øvelser om emnet.
Isotermisk, isovolumetrisk og adiabatisk transformation. Mød dem!
Ved du hvad termodynamik er? Få adgang til teksten for at finde ud af, hvilke der er de vigtigste begreber om emnet, lære om termodynamikkens love.



