dobbelt salt er navnet på en af de klassifikationer, som uorganiske salte kan modtage. De andre klassifikationer er: enkle, alun, hydroxyleret, hydrogeneret og hydreret. For at blive karakteriseret som et dobbelt salt skal et uorganisk salt have en af nedenstående kombinationer:
En kation (Y) og to anioner (X og W) og er repræsenteret af følgende formel:
YXW
En anion (X) og to kationer (Y og Z) og er repræsenteret ved følgende formel:
YZX
Bemærk: Disse salte dannes, når en neutraliseringsreaktion udføres mellem to baser anderledes og en syreeller mellem to forskellige syrer og en base.
Navngivningsregel for et dobbelt salt
For at navngive en dobbelt salt, er det først nødvendigt at kende dets sammensætning, fordi der for hver type dobbelt salt er en specifik navngivningsregel, som det kan ses nedenfor:
a) Nomenklaturregel for dobbelt salt med to kationer
Når en dobbelt salt har to kationer, skal vi bruge følgende regel:

Nomenklaturregel anvendt til dobbeltsalte med to kationer
Følgende er to eksempler på anvendelse af denne navngivningsregel:
1. eksempel: Linie4s
Dette salt består af:
Anion: sulfid (S-2);
Mere elektropositivt kation: lithium (Li+1);
Mindre elektropositivt kation: ammonium (NH4+1).
Derfor er navnet lithium (dobbelt) ammoniumsulfid.
2. eksempel: RbCaBO3
Dette salt består af:
Anion: borat (BO3-3);
Mere elektropositivt kation: rubidium (Rb+1);
Mindre elektropositivt kation: calcium (Ca+2).
Således er dets navn borat (dobbelt) af rubidium og calcium.
b) Nomenklaturregel for dobbelt salt med to anioner
Når en dobbelt salt har to anioner, skal vi bruge følgende regel:
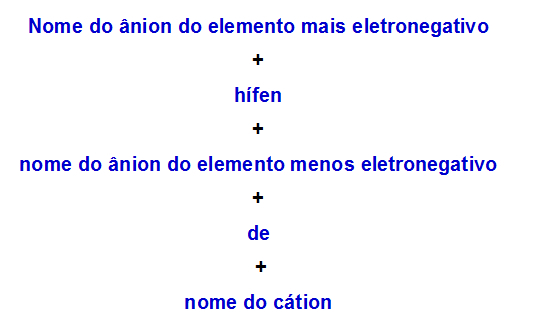
Nomenklaturregel anvendt til dobbeltsalte med to anioner
Her er to eksempler på anvendelse af denne regel:
1. eksempel: MgFI
Dette salt består af:
Kation: magnesium (mg+2);
Mest elektronegative anion: fluor (F-1);
Mindre elektronegativ anion: iodid (I-1).
Derfor er navnet magnesiumfluorid-iodid.
2. eksempel: ZnNO2br
Dette salt består af:
Kation: zink (Zn+2);
Mere elektronegativ anion: nitrit (NO2-1);
Mindre elektronegativ anion: bromid (Br-1).
Derfor er dens navn zinknitrit-bromid.
Samling af formlen for et dobbelt salt fra dens nomenklatur
a) Til dobbelt salt med to kationer
Konstruktionen af formlen a dobbelt salt det afhænger af at kende dets navn, som er standardiseret som i alt salt, det vil sige først kationen og derefter anionen. Da dobbelt salt kan have to kationer, følger deres rækkefølge og placering i formlen det givne navn.
1. eksempel: bariumnikkelpyrophosphat II
Dette salt indeholder fosfat (P2O7), barium (Ba+2) og nikkel II (Ni+2), kationer skrevet i den rækkefølge. Så dens formel er BaNiP2O7.
2. eksempel: kobber II fosfat og guld I
Dette salt har fosfat (PO4-3), kobber II (Cu+2) og guld I (Au+1), kationer skrevet i den rækkefølge. Derfor er dens formel CuAuPO4.
b) Til dobbelt salt med to anioner
I tilfælde af dobbelt salt med to anioner følger vi også, når vi placerer anionerne i formlen, rækkefølgen, som de vises i det givne navn.
1. eksempel: nikkelsulfat-iodid III
Dette salt har sulfatanioner (SO4-2) og iodid (I-1), skrevet i denne rækkefølge, og nikkel III-kationen (Ni+3). Så dens formel er NiSO4JEG.
2. eksempel: blycyanidphosphat IV
Dette salt har fosfatanioner (PO4-3) og cyanid (CN-1), skrevet i denne rækkefølge, og blykationen IV (Pb+4). Så dens formel er PbPO4CN.
Af mig Diogo Lopes Dias
Kilde: Brasilien skole - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-um-sal-duplo.htm


