Brændstofferne i de fleste biler er benzin og ethanol. Den komplette forbrænding af disse to brændstoffer genererer kuldioxid (CO2 (g)) og vand (H2O). Desværre kan ufuldstændig forbrænding og urenhederne i alkohol og benzin generere stoffer, der er meget forurenende for miljøet. I tilfælde af benzin, kulilte (CO(g)); carbonhydrider (forbindelser bestående af kulstof og brint), såsom ethan (C2H6 (g)); og nitrogenoxider (NOx), hovedsageligt nitrogenmonoxid (NO) og nitrogendioxid (NO2 (g)).
For at undgå en stigning i luftforurening har alle biler brug for udstyr, der kaldes katalysator eller katalysator, som er en forureningsbekæmpelsesindretning, som har til opgave at behandle disse gasser, der frigives af forbrændingsmotoren, og omdanne dem til mindre skadelige gasser. Katalysatorer anvendes også til dette formål i nogle industrielle processer.
De nævnte forurenende gasser forlader motoren og kommer ind i katalysatoren og passerer gennem en slags "bikube", hvis celler generelt er fremstillet af keramisk eller metallisk materiale, der er overtrukket med aluminiumoxid (aluminiumoxid - Al
2O3). Denne bikageform med små kanaler er vigtig, fordi den giver en stor kontaktflade til gasserne, hvilket får dem til at reagere hurtigere.Men den virkelige katalysator er et metal, der sidder oven på aluminiumoxid. De anvendte metaller er typisk palladium, rhodium, platin eller molybdæn. Du kan også blande disse metaller og bruge legeringer. For eksempel anvendes i tilfælde af benzin normalt en legering af palladium og thorium; i tilfælde af ethanol anvendes en anden legering af palladium og molybdæn. Disse metaller udfører en heterogen katalyse med forurenende gasser.
heterogen katalyse det er en reaktionstype, hvor katalysatoren sammen med reaktanterne (i dette tilfælde de forurenende gasser) danner et polyfasesystem. Dette skyldes, at katalysatoren adsorberer, det vil sige, at den bibeholder molekylerne af reaktanterne på overfladen, svækker deres bindinger og gør reaktionsprocessen hurtigere.
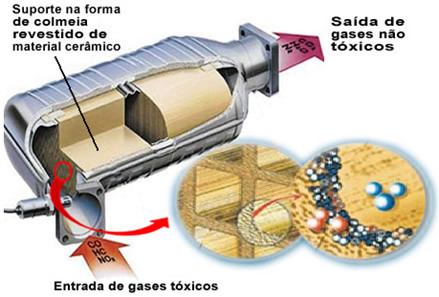
Katalysatormetaller omdanner således forurenende stoffer, såsom CO og NOx i ikke-giftige gasser såsom CO2, H2O, O2 og nej2. Se nogle af disse reaktioner nedenfor og bemærk, at der gennem dem er oxidation af kulbrinter og CO (afledt af ufuldstændig forbrænding) og også reduktion af nitrogenoxider til nitrogengas (N2):
2 CO(g) + 2 NEJ(g) → 2 CO2 (g) + 1 N2 (g)
2 CO(g) + 1 O2 (g) → 2 CO2 (g)
2C2H6 (g) + 7 O2 (g) → 4 CO2 (g) + 6 H2O(v)
2 NEJ2 (g) +4 CO(g) → 1 N2 (g) + 4 CO2 (g)
2 NEJ2 (g) → 1 N2 (g) + 2 O2 (g)
2 NEJ(g) → 1 N2 (g) + 1 O2 (g)
Af Jennifer Fogaça
Uddannet i kemi
Kilde: Brasilien skole - https://brasilescola.uol.com.br/quimica/conversor-catalitico.htm
