Normalt reaktionerne fra vandig elektrolyse og magtfri elektrolyse de udføres med grafit- og platinelektroder, som ikke deltager i reaktionen; de leder kun elektrisk strøm. Der er dog nogle specifikke tilfælde, hvor det er nødvendigt at bruge aktive elektroder, det vil sige, der gennemgår reduktion og oxidation.
De vigtigste anvendelsestilfælde af disse elektroder, der deltager i redox-processen, er: a elektrolytisk metalrensning, såsom zink, cobalt, nikkel og især kobber; og også galvanisering. Lad os se, hvordan hvert tilfælde opstår:
• Elektrolytisk rensning af kobber: denne elektrolytiske kobberraffinering kan producere en renhed på ca. 99,9% og bruges hovedsageligt til fremstilling kobbertråde, som, hvis de har mindst mulig urenhed, kan have deres evne til at lede meget elektrisk strøm formindsket.
Overhold, hvordan denne proces finder sted, se skematisk af et elektrolytisk kar samlet nedenfor:

En potentiel forskel påføres den vandige kobbersulfatopløsning (CuSo4 (aq)) - som leder elektricitet - så anoden, som er et urent metallisk kobber, mister elektroner, dvs. den gennemgår oxidation og frigiver kationerne (Cu
2+), som deponeres på den negative plade. Dette kunne være en inert platinplade, eller bedre, en ren kobberplade. Det udgør katoden, som reduceres, efterhånden som der afsættes kobber i den. Således er de halvreaktioner, der forekommer i elektroderne: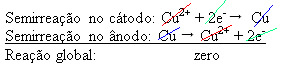
Det faktum, at det gav et nulresultat, indikerer, at der ikke var nogen kemisk reaktion, men kun transport af kobber. Nederst i beholderen er de andre urene stoffer, der var i kobber, såsom guld, sølv, silica (sand) og andre mineraler, som endda kan sælges.
• Galvanisering: en metalbelægning påføres et materiale, der skal beskyttes mod korrosion.
Det valgte metal til belægningen - som kan være forkromning (forkromning), nikkel (fornikling), sølv (forsølvning), guld (forgyldning) eller zink (galvanisering) - vil være den anode, positive elektrode, som gennemgår oxidation og mister elektroner. Det gennemgår oxidering i stedet for det materiale, der er blevet beskyttet, fordi dets reduktionspotentiale er større.
Den negative elektrode, det vil sige katoden, der modtager disse elektroner og gennemgår reduktion, er selve materialet, der blev overtrukket. På denne måde forbliver den beskyttet, selvom dens overflade på en eller anden måde krænkes.
Af Jennifer Fogaça
Uddannet i kemi
Kilde: Brasilien skole - https://brasilescola.uol.com.br/quimica/eletrolise-com-eletrodos-ativos.htm
