I 1786 dissekerede den italienske anatom Luigi Galvani (1737-1798) en frø på sit bord, hvor der var en elektrostatisk maskine. Galvani så dyrets muskler trække sig sammen, da hans assistent ved et uheld rørte spidsen af hans skalpel til den indre nerve af frøens lår. Med andre ord skete dette, når frøens væv blev rørt af to forskellige metaller.
Fra det øjeblik begyndte Galvani at forsvare en teori, der forsøgte at forklare denne kendsgerning: teorien om "animalsk elektricitet". Ifølge Galvani var metaller bare ledere af elektricitet, som i virkeligheden ville være indeholdt i frøens muskler.
Hans teori var imidlertid forkert, og dette blev set af den italienske fysiker Alessandro Volta (1745-1827), der udførte flere eksperimenter og bemærkede, at når pladen og tråden var lavet af det samme metal, så krampeanfaldene ikke frem, hvilket viste, at der ikke var nogen strøm af elektricitet. Således fortsatte han med at forsvare det (korrekte) koncept om, at elektricitet ikke stammer fra frøens muskler, men fra metaller, og at dyrets væv førte denne elektricitet.
For at bevise, at han var korrekt, lavede Volta et kredsløb dannet af en elektrolytisk opløsning, det vil sige en opløsning med ioner opløst, som han kaldte våd leder eller andenklasses leder, placeret i kontakt med to elektroder metallisk. Disse sidste kaldte Alessandro Volta tørledere eller ledere af første klasse.
Han gjorde dette ved at placere en våd leder (som var en vandig saltopløsning) mellem to tørre ledere (som var metaller forbundet med en ledende ledning). I det øjeblik observerede han, at den elektriske strømning var ved at vågne op. Han kom også til at forstå, at afhængigt af de metaller, han brugte, kunne strømmen være større eller mindre. Således kan vi indrømme, at ideen om, hvad en bunke er, allerede blev forstået og forklaret af Volta.
I 1800 oprettede Volta den første elektriske celle, der blev kaldt bageste bunke, galvanisk bunke eller voltaisk celle og stadig, "rosenkrans". Et skematisk billede af denne bunke er vist nedenfor: han placerede en kobberskive oven på en filtskive gennemblødt i en opløsning af svovlsyre og til sidst en zinkskive; og så videre, stabling af disse serier i en stor søjle. Kobber, filt og zink havde et hul i midten og blev gevindskåret på en vandret stang og blev således forbundet med en ledende ledning.
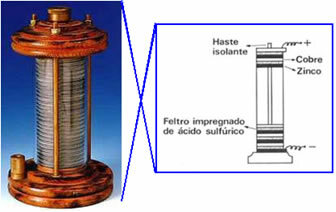
Dette eksperiment forårsagede omvæltninger i den videnskabelige verden og fra da af alle enheder, der producerede elektricitet fra processer kemikalier (det vil sige, der producerede kemisk energi til elektrisk energi) blev kaldt voltaiske celler, galvaniske celler eller, simpelthen batterier.
Volta gjorde det samme eksperiment med forskellige metaller og elektrolytopløsninger, såsom sølv- og zinkskiver adskilt af saltlaksblødgjorte flanelskiver. Han udførte endda en demonstration af denne opdagelse for Napoleon Bonaparte, som det fremgår af figuren nedenfor, på Academy of Sciences i Paris.

Alessandro Volta demonstrerer sin opdagelse for Napoleon
En anden Volta's eksperiment med batterier var krans af briller, hvor han placerede to plader af forskellige metaller, der var forbundet med hinanden med en ledende ledning, men adskilt af elektrolytopløsninger.
Vi ved nu, at hvad der sker i en celle, som dem der er skabt af Volta, er at elektricitet strømmer fra polen. negativ, kaldet anoden, som oxiderer, mister elektroner til den positive pol, kaldet katoden, som reducerer, vinder elektroner.
Disse batterier fremstillet i vandig opløsning bruges ikke meget i dag; bare med hensyn til forskning, men de var det princip, der udviklede de moderne batterier, vi kender i dag som batterier tørre, og som er langt mere praktiske at bruge og bære, samt give en tilfredsstillende elektrisk strøm til meget mere. tid.
Af Jennifer Fogaça
Uddannet i kemi
Kilde: Brasilien skole - https://brasilescola.uol.com.br/quimica/historia-das-pilhas.htm