De oxidationsreduktionsreaktioner, der hovedsageligt studeres i fysisk kemi, er dem, hvor elektronoverførsel finder sted. Den reagerende art (atom, ion eller molekyle), der mister en eller flere elektroner, er den, der gennemgår oxidation. Den kemiske art, der modtager elektroner, reduceres på den anden side.
Generelt kaldes det, når denne type reaktion undersøges i uorganisk kemi enkel udvekslingsreaktion eller af forskydning.
For at enhver reaktion skal finde sted er det nødvendigt at opfylde visse betingelser. En af dem er, at der skal være kemisk affinitet mellem reagenserne, dvs. de skal interagere på en sådan måde, at de muliggør dannelse af nye stoffer.
I tilfælde af redoxreaktioner betyder affinitet, at en af reaktanterne har tendens til at få elektroner, og den anden har tendens til at miste elektroner. Denne tendens svarer til reaktivitet af de involverede kemiske grundstoffer.
Lad os se, hvordan det er muligt at sammenligne reaktiviteten mellem metaller.
Antag, at vi vil opbevare en opløsning af kobber II-sulfat (CuSO
4). Vi kunne umuligt placere denne opløsning i en aluminiumsbeholder, fordi følgende reaktion ville forekomme:2 Al(s) + 3 CuSO4 (aq)→ 3 Cu(s) + Al2(KUN4)3 (aq)
Bemærk, at aluminium har oxideret, mistet 3 elektroner hver og bliver aluminiumskation:
Al(s) → Al3+(her) + 3 og-
Samtidig kobberkationen (Cu2+), der var til stede i opløsningen, modtog elektroner fra aluminium og blev reduceret og blev metallisk kobber. Hver kobberkation modtager to elektroner:
Røv2+(her) + 2 og- → Cu(s)
Men hvis det var omvendt, og vi ønskede at opbevare en opløsning af aluminiumsulfat (Al2(KUN4)3 (aq)), ville det ikke være et problem at sætte det i en kobberbeholder, da denne reaktion ikke ville forekomme:
Røv(s) + Al2(KUN4)3 (aq) → forekommer ikke
Disse observerede fakta kan forklares ved, at aluminium er mere reaktivt end kobber.
Metaller har en tendens til at opgive elektroner, det vil sige at oxidere. Når man sammenligner forskellige metaller, den med den største tendens til at donere elektroner er den mest reaktive. Derfor er reaktiviteten af metaller også forbundet med deres ioniseringsenergidet vil sige den mindste energi, der er nødvendig for at fjerne en elektron fra det gasformige atom i dets jordtilstand.

Baseret på dette er metalreaktivitetskø eller række elektrolytiske spændinger, vist nedenfor:
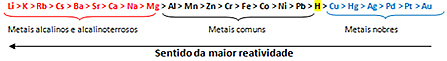
Det mest reaktive metal reagerer med ioniske stoffer, hvis kationer er mindre reaktive. Med andre ord reagerer metallet til venstre med stoffet dannet af ioner til højre. Det modsatte sker ikke.
Husk det givne eksempel, se i reaktivitetsrækken, at aluminium (Al) er til venstre for kobber (Cu). Derfor reagerer aluminium med opløsningen dannet af kobberkationer; men kobber reagerer ikke med en opløsning dannet af aluminiumkationer.
Bemærk, at det mest reaktive metal er lithium (Li), og det mindst reaktive er guld (Au).

Dette er en af grundene til, at guld er så værdifuldt, for hvis det ikke reagerer, forbliver det intakt i lang tid. Dette kan ses i de guldbelagte egyptiske sarkofager og skulpturer, der dateres tilbage til den mest afsides antikhed. Vi visualiserer det også, når vi sammenligner holdbarheden af et rent guldsmykke med smykker fremstillet af andre metaller, der er mere reaktive end guld.

Af Jennifer Fogaça
Uddannet i kemi
Kilde: Brasilien skole - https://brasilescola.uol.com.br/quimica/ordem-reatividade-dos-metais.htm