Hvis det var muligt at visualisere strukturen af et metal meget tydeligt, ville vi se det som på billedet ovenfor. Metallernes atomstruktur er krystallinsk, som består af metalkationer omgivet af elektroner.
De krystallinske gitter, der er til stede i metaller, kan repræsenteres som følger: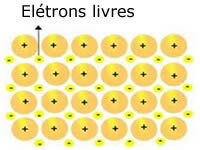
Repræsentation af metallisk natrium (Na)
De krystallinske gitter af metaller dannes af en gruppe faste kationer.
Hver Na + -kation er omgivet af elektroner, men disse delokaliseres, dvs. de er ikke tiltrukket af nogen kerne.
Da der ikke er nogen tiltrækning mellem negative ladninger (elektron) og den positive kerne (kation), ender de frie elektroner med at optage hele metalets krystallinske gitter. Den frihed, som elektroner har til at bevæge sig, får dem til at danne en elektronisk sky.
Metallers evne til at lede elektricitet forklares med tilstedeværelsen af denne sky. Elektrisk strøm skyldes kontakt med frie elektroner med andre metaller.
I sammensætningen af ethvert atom, herunder metaller som natrium (Na), guld Au, kobber (Cu), er der et valenslag. Elektroner bevæger sig frit gennem dette lag og opretholder den elektromagnetiske tiltrækning for kationer. Denne strukturelle egenskab tillader dannelse af metalliske molekyler og følgelig af selve metallerne.
Af Líria Alves
Uddannet i kemi
Kilde: Brasilien skole - https://brasilescola.uol.com.br/quimica/como-se-forma-ligacao-metalica.htm
