Til periodiske tabel familier er de lodrette sekvenser af tabellen og samle kemiske elementer med lignende kemiske egenskaber. Sådanne ligheder skyldes tilstedeværelsen af lige store mængder valenselektroner for grundstofferne grupperet i samme familie. Familier rummer de repræsentative elementer i gruppe 1 og 2, fra 13 til 18 og overgangselementerne i gruppe 1 til 12.
Læs også:Transuraniske grundstoffer - de menneskeskabte kemiske grundstoffer, der kommer efter uran i det periodiske system
Emner i denne artikel
- 1 - Sammenfatning af familier i det periodiske system
- 2 - Organisering af periodiske systemfamilier
-
3 - Nomenklatur for familierne i det periodiske system
- → Repræsentative elementer i det periodiske system
- → Overgangselementer i det periodiske system
- 4 - Kemiske grundstoffer i det periodiske system-familier
-
5 - Hovedkarakteristika for familierne i det periodiske system
- → Gruppe 1 eller familie af alkalimetaller
- → Gruppe 2 eller familie af jordalkalimetaller
- → Gruppe 3 til 12 eller familie af overgangsmetaller
- → Gruppe 13 eller borfamilie
- → Gruppe 14 eller kulstoffamilie
- → Gruppe 15 eller nitrogenfamilie
- → Gruppe 16 eller iltfamilie (kalkogener)
- → Gruppe 17 eller familie af halogener
- → Gruppe 18 eller ædelgasfamilie
-
6 - Periodisk system og elektronisk distribution
- → Elektronisk distribution af repræsentative elementer
- → Elektronisk distribution af overgangselementer
- 7 - Løste øvelser om familierne i det periodiske system
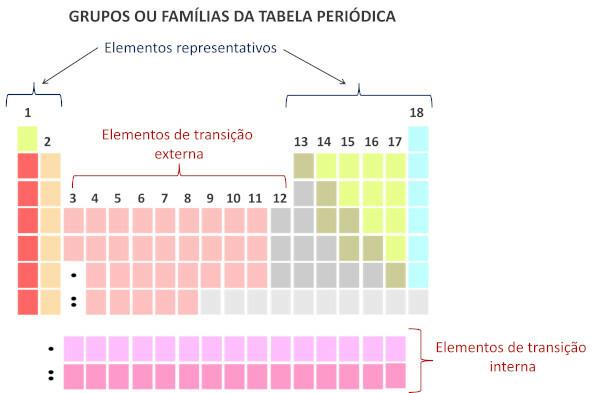
Oversigt over periodiske systemfamilier
Familierne svarer til de lodrette linjer i Periodiske system.
Også kendt som grupper, er familier i det periodiske system nummereret fra 1 til 18.
Kemiske grundstoffer i samme familie har lignende kemiske egenskaber.
Kendskabet til et sæt af elementer forklares ved at have lige mange valenselektroner.
De repræsentative elementer er opdelt i gruppe 1, 2, 13, 14, 15, 16, 17 og 18. Hver af disse familier har specifikke navne.
Overgangselementerne danner en enkelt familie, der er opdelt i grupperne 3, 4, 5, 6, 7, 8, 9, 10, 11 og 12.
Stop ikke nu... Der er mere efter reklamen ;)
Organisation af periodiske systemfamilier
Familier i det periodiske system er tabellens lodrette rækkefølger, altså søjlerne. Også kendt som grupper, familierne i det periodiske system er nummereret fra 1 til 18, fra venstre mod højre.
Kemiske grundstoffer, der optager den samme søjle, anses for at være i samme familie., på grund af ligheden mellem deres kemiske egenskaber, hvilket skyldes, at de har det samme antal af elektroner på valensskal. For eksempel har alle kemiske grundstoffer i familie 18 otte elektroner i valensskallen (fuld skal) og deltager sjældent i kemiske bindinger.
Ifølge det moderne system af International Union of Pure and Applied Chemistry (Iupac), er hver gruppe eller familie identificeret med et tal fra 1 til 18, startende fra venstre mod højre i det periodiske system.
Det er vigtigt at fremhæve, at det gamle IUPAC-system vedtog et alfanumerisk system, hvor bogstaverne A og B refererer til henholdsvis de repræsentative og overgangselementer. I øjeblikket bruges denne type nomenklatur ikke længere.
Nomenklatur for familier af det periodiske system
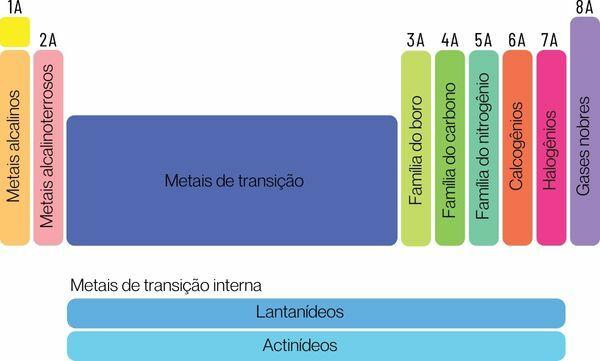
Kemiske grundstoffer kan klassificeres i to store familier: repræsentative elementer og overgangselementer.
→ Repræsentative elementer i det periodiske system
De repræsentative elementer er opdelt i gruppe 1, 2, 13, 14, 15, 16, 17 og 18. Hver af disse grupper har et specifikt navn, som det også kan kendes under. Se:
Gruppe 1: familie af metaller alkalisk.
Gruppe 2: familie af jordalkalimetaller.
Gruppe 13: bor- eller jordmetalfamilie.
Gruppe 14: kulstoffamilie.
Gruppe 15: Nitrogen eller Pnicogens familie.
Gruppe 16: oxygen- eller kalkogenfamilie.
Gruppe 17: familie af halogener.
Gruppe 18: familie af ædelgasser.
→ Overgangselementer i det periodiske system
Du overgangselementerdanne en enkelt familie opdelt i grupperne 3, 4, 5, 6, 7, 8, 9, 10, 11 og 12. Lanthanid- og actinid-serien er også en del af overgangselementerne.
Overgangselementerne er alle metalliske og har lignende kemiske egenskaber, selv med forskellige elektroner i valensskallen og ville derfor danne en enkelt og stor familie af overgangsmetaller.
Kemiske grundstoffer fra familierne i det periodiske system
Hver familie eller gruppe er sammensat af et sæt kemiske grundstoffer. Se beskrivelsen af de kemiske grundstoffer, der udgør hver familie:
Gruppe 1:lithium, natrium, kalium, rubidium, cæsium, francium.
Gruppe 2:beryllium, magnesium, calcium, strontium, barium, radio.
Gruppe 3:skandium, yttrium, lanthanidserier og actinidserier.
Gruppe 4: titanium, zirconiaO, hafnium det er rutherfordium.
Gruppe 5:vanadium, niobium, tantal det er dubnium.
Gruppe 6:krom, molybdæn, wolfram det er seaborgium.
Gruppe 7:mangan, technetium, rhenium det er bohrio.
Gruppe 8: jern, ruthenium, osmium det er hassium.
Gruppe 9:koboltrhodium, iridium og meitnerium.
Gruppe 10:nikkel, palladium, platin og darmstadtio.
Gruppe 11: kobber, sølv, guld og røntgenium.
Gruppe 12:zink, cadmium, Merkur og Copernicus.
Gruppe 13: bor, aluminium, gallium, indium og thallium.
Gruppe 14: kulstof, silicium, germanium, tin, at føre og flerovium.
Gruppe 15:nitrogen, fosfor, arsenik, antimon det er vismut.
Gruppe 16:ilt, svovl, selen, tellur, polonium og livermorium.
Gruppe 17: fluor, klor, brom, jod og astatin.
Gruppe 18:helium, neon, argon, krypton, xenon det er radon.
Vigtig: det kemiske grundstof brint er et særligt tilfælde, for på trods af at den er placeret ved siden af gruppe 1, er den ikke en del af alkalimetalfamilien, da den ikke deler lignende kemiske egenskaber.
Få mere at vide: Hvad er de radioaktive grundstoffer i det periodiske system?
Hovedkarakteristika for familierne i det periodiske system
De er metalliske faste stoffer, skinnende og glatte.
De har høj varmeledningsevne og høj Elektrisk ledningsevne.
har temperaturer relativt lav smeltning.
De er meget reaktive med vand.
Tendens til at danne monovalente kationer (ladning +1).
De er metalliske faste stoffer, skinnende og hårdere sammenlignet med alkalimetaller.
De oxiderer let.
De har høj varmeledningsevne og høj elektrisk ledningsevne.
De har lidt højere smeltetemperaturer sammenlignet med alkalimetaller.
De reagerer med vand.
Tendens til at danne divalente kationer (ladning +2).
De er den største familie i det periodiske system.
Hårde, skinnende metalliske faste stoffer.
De har høj varmeledningsevne og høj elektrisk ledningsevne.
Tæt.
Høje smeltetemperaturer.
kan præsentere anderledes oxidationstilstande.
→ Gruppe 13 eller borfamilie
De har mellemegenskaber mellem egenskaberne af metaller og ikke metaller.
De er solide under omgivende forhold.
Tendens til at danne trivalente kationer (ladning +3).
→ Gruppe 14 eller kulstoffamilie
De har mellemliggende egenskaber mellem egenskaberne af metaller og ikke-metaller.
De er solide under omgivende forhold.
Tendens til at danne fire bindinger.
De er solide under omgivende forhold.
Kulstof og silicium kan danne kædebindinger.
→ Gruppe 15 eller nitrogenfamilie
De har mellemliggende egenskaber mellem egenskaberne af metaller og ikke-metaller.
Faste stoffer under omgivende forhold, med undtagelse af nitrogen, som er en gas.
Nitrogen og fosfor er grundlæggende i levende organismer.
Arsen er meget giftigt.
→ Gruppe 16 eller iltfamilie (kalkogener)
De har forskellige egenskaber, der skifter fra ikke-metallisk til metallisk grundstof, efterhånden som du går ned i familien.
Faste stoffer under omgivende forhold, med undtagelse af oxygen, som er en gas.
Tendens til at danne divalente anioner (ladning -2).
→ Gruppe 17 eller familie af halogener
De er ikke-metaller.
Ganske reaktivt.
Dårlige termiske og elektriske ledere.
Under omgivende forhold findes fluor og klor som gasser, brom er flydende og jod er fast.
Tendens til at danne monovalente anioner (ladning -1).
→ Gruppe 18 eller ædelgasfamilie
De er ikke-metaller.
Meget lidt reaktive, så de kan kaldes inerte gasser.
De findes i form af gasser.
De har ingen tendens til at dannes ioner.
Det periodiske system og elektronisk distribution
Kemiske grundstoffer, der tilhører samme familie eller gruppe, har lignende kemiske egenskaber, fordi de har lige mange elektroner i valensskallen.
Antallet af elektroner i valensskallen er relevant, da det bestemmer tendensen til dannelse af kationer eller anioner, typen af kemisk binding, der skal dannes, energien involveret i kemiske reaktioner, blandt andet egenskaber. For at finde antallet af valenselektroner, det er nødvendigt at kende Atom nummer af elementet og udføre din elektronisk distribution.
→ Elektronisk distribution af repræsentative elementer
De repræsentative elementer har deres mest energiske elektroner i underniveauer s det er P af det elektroniske lag (n). Følgende tabel samler de elektroniske konfigurationer forbundet med hver familie af repræsentative elementer. begrebet n varierer fra 1 til 7 og repræsenterer energiniveauet optaget af valenselektronerne, svarende til perioden (vandret linje) i det periodiske system, hvor grundstoffet findes.
Elektronisk distribution af repræsentative elementer | ||
familie eller gruppe |
Elektronisk distribution |
Eksempel |
1 |
os1 |
Li (Z=3): 1s2 2s1 |
2 |
os2 |
Vær (Z=4): 1s2 2s2 |
13 |
os2 np1 |
B (Z=5): 1 s2 2s22 p1 |
14 |
os2 np2 |
C (Z=6): 1 s2 2s22 p2 |
15 |
os2 np3 |
N (Z=7): 1 s2 2s22 p3 |
16 |
os2 np4 |
O (Z=8): 1 s2 2s22 p4 |
17 |
os2 np5 |
F (Z=9): 1 s2 2s22 p5 |
18 |
os2 np6 |
Ne (Z=10): 1s2 2s22 p6 |
→ Elektronisk distribution af overgangselementer
Overgangselementerne er fordelt mellem gruppe 3 og 12 og har underniveauerne d det er f besat af valenselektroner:
Eksterne overgangselementer: holde valenselektroner i underniveauet d, ved at holde elektronkonfigurationen lig med os2 (n-1)d(1 til 8). For eksempel hører grundstoffet nikkel (Z = 28) til gruppe 10, og dets konfiguration er 1s2 2s2 2 p6 3s2 3 s6 4s2 3d8.
Interne overgangselementer: de er en del af gruppe 3, men er "interne" i det periodiske system, idet de udvides under det, i periode 6 (lanthanider) og 7 (aktinider). Disse elementer har valenselektroner, der optager underskallen f og generel elektronisk konfiguration af os2 (n-2)f(1 til 13). For eksempel er grundstoffet lanthan (Z = 57) det første grundstof i lanthanidserien, og dets elektronkonfiguration er 1s2 2s2 2 p6 3s2 3 s6 4s2 3d10 4 p6 5s2 4d10 5 s6 6s2 4f1.
Ved også:Hvad er oprindelsen af det periodiske system?
Løste øvelser om familierne i det periodiske system
Spørgsmål 1
(UFC — tilpasset) Med hensyn til den moderne periodiske klassificering af grundstoffer, sæt kryds ved den sande erklæring:
A) I det periodiske system svarer familier eller grupper til vandrette linjer.
B) Grundstoffer i en familie har meget forskellige kemiske egenskaber.
C) I en familie har grundstoffer generelt det samme antal elektroner i den sidste skal.
D) I en periode har grundstofferne lignende kemiske egenskaber.
E) De repræsentative elementer er fordelt i gruppe 3 til 12.
Løsning:
Alternativ C
Punkt A er forkert: familierne eller grupperne er kolonnerne (lodrette linjer) i det periodiske system.
Punkt B og D forkert: I en familie har grundstoffer lignende kemiske egenskaber. I perioder har grundstoffer den samme elektronskal optaget af valenselektroner.
Punkt C korrekt: I en familie har grundstofferne det samme antal elektroner i den sidste skal.
Punkt E forkert: Repræsentative elementer er gruppe 1, 2, 13, 14, 15, 16, 17 og 18. Overgangselementerne er fordelt i gruppe 3 til 12.
spørgsmål 2
(EAM) Elementerne A, B og C har følgende elektronkonfigurationer i deres valensskaller:
A: 3s1
B: 4s2 4 p4
C: 3s2
Ud fra disse oplysninger skal du vælge den korrekte mulighed.
A) Grundstof A er et alkalimetal.
B) Element B er et halogen.
C) Grundstof C er et kalkogen.
D) Grundstofferne A og B tilhører den tredje periode i det periodiske system.
E) De tre grundstoffer tilhører samme gruppe i det periodiske system.
Løsning:
Alternativ A
Punkt A korrekt: Grundstof A har en elektronisk fordeling, der kun indeholder én valenselektron, derfor tilhører det gruppe 1 i det periodiske system.
Forkert element B: element B har en 4s elektronkonfiguration2 4 p4, hvilket indikerer, at der er 6 elektroner i den sidste skal, og at dette grundstof tilhører gruppe 16 (chalcogener).
Forkert punkt C: element C har en elektronisk konfiguration med 2 elektroner i den sidste skal, så det er et element i gruppe 2 i tabellen.
Forkert element D: element A hører til den tredje periode (n = 3), og element B hører til fjerde periode (n = 4).
Forkert punkt E: de tre grundstoffer har forskellige mængder af elektroner i den sidste skal, så de kan ikke være en del af samme familie.
Af Ana Luiza Lorenzen Lima
Kemi lærer
Klik her, lær, hvad et valenslag er, og find ud af, hvordan det kan identificeres.
Forstå, hvordan elektronisk distribution foregår, og se eksempler.
Lær om de særlige forhold ved de interne overgangselementer (actinider og lanthanider), som optager den sjette og syvende periode i gruppe 3 i det periodiske system.
Kend de eksisterende kemiske grundstoffer, forstå, hvad de er, og hvordan man repræsenterer dem.
Ædelgasser er de eneste grundstoffer, der findes i isoleret form i naturen. Lær mere om dem her i denne artikel!
Lær om halogener, deres egenskaber, egenskaber og deres vigtigste anvendelser i hverdagen.
Lær mere om jordalkalimetaller, at kende egenskaber, egenskaber og anvendelser.
Forstå, hvad atomnummer er, og lær, hvad der er karakteristika ved atomet, der kan bestemmes ud fra det.
Tjek her, hvad det periodiske system er, og se en interaktiv model, så du kan kende alle de kemiske grundstoffer, der udgør det.