EN sublimering Det er en ændring i stoffets fysiske tilstand karakteriseret ved den direkte passage fra den faste fase til den gasformige fase uden at passere gennem den flydende fase. Strengt taget kan ethvert stof undergå sublimering, men under specifikke forhold med tryk og temperatur. Sublimering er korreleret med damptrykket i den faste fase, såvel som med de intermolekylære interaktioner, der udøves af de faste stoffer.
Denne proces kan let observeres i et stykke tøris, som består af fast kuldioxid. Kuldioxid sublimerer under tryk og ved stuetemperatur. Den modsatte proces til sublimering kan kaldes resublimering eller aflejring. For at sublimering kan forekomme, skal stof absorbere energi, så det betragtes som en endoterm proces.
Læs også: Hvad er materiens fysiske tilstande?
Sammenfatning om sublimering
Sublimering er den direkte passage fra den faste fase til den gasformige fase, uden at gå gennem den flydende fase.
Specifikke betingelser for tryk og temperatur er nødvendige for at observere sublimeringen af et stof.
Sublimering er påvirket af termodynamiske aspekter, såsom damptryk i den faste fase og intermolekylære interaktioner.
Sublimering er en endoterm proces.
Et eksempel på sublimering er, hvad der sker i tøris, som består af fast kuldioxid.
Hvad er sublimering?
sublimation er den direkte overgang fra fast fase til gasfaseuden at gå gennem væskefasen. Det forekommer under specifikke temperatur- og trykforhold for nogle faste stoffer. Denne overgang er en fysisk tilstandsændringsproces, der ikke involverer kemiske reaktioner.
Den omvendte proces, dvs. den direkte passage fra den gasformige fase til den faste fase, kaldes forskelligt. Nogle forfattere beholder ordet sublimering for denne faseændring, mens andre bruger "gensublimering" og endda "aflejring".
Hvordan sublimering virker
Der kan drages en parallel mellem sublimering og fordampning. I begge tilfælde er endepunktet gasfase. Forskellen er naturligvis i startfasen: faststof til sublimering og væske til fordampning.
I begge tilfælde der er påvirkning af tryk fordampning og også termodynamiske aspekter, der involverer varme og intermolekylære interaktioner.
Hvad er damptryk?
I en lukket beholder, der indeholder en væske, er det muligt at opfatte, at der er en ligevægt mellem væskefasen og dampfasen. Dette sker, fordi selv under kogetemperaturen er den tilstedeværende energi tilstrækkelig til, at nogle molekyler af væsken kan løsne sig og passere ind i dampen. Nogle dampmolekyler kan dog også kondensere igen og vende tilbage til væskefasen, hvilket demonstrerer processens reversibilitet.
Denne damp, der er lavet af stof (har masse og volumen), øvelser tryk på væskens overflade, kendt som damptryk. Det afhænger ikke af mængden af væske, men af temperaturen, for jo højere temperatur, jo lettere løsnes molekylerne fra væskefasen.
Væsker, der har et højt damptryk ved almindelige temperaturer, kaldes flygtige. For eksempel ved 25°C har ethylether et damptryk på 0,58 atm, acetone (propanon) har et damptryk på 0,29 atm, mens vand har et damptryk på 0,023 atm. Forresten, når damptrykket er identisk med det atmosfæriske tryk, koger væsken. For at lære mere om damptryk, klik her.
Damptryk og sublimering
Skønt i mindre grad, faste stoffer har også damptryk, men meget lavere end for væsker. For eksempel, selv ved en temperatur på 1000 K er jernets damptryk kun 9,21 x 10-20 atm. Men nogle faste stoffer formår at undergå sublimering, såsom jod, der præsenterer et højere damptryk ved normale temperaturer (4 x 10-4 atm).
Dette er kun muligt med passage af molekyler fra den faste tilstand direkte til den gasformige tilstand. For at dette kan ske, skal molekyler af det faste stof skal være til stede intermolekylære interaktioner svag (i jod er de f.eks. af typen induceret dipol-induceret dipol).
Det ses også sublimeringsprocessen er endoterm, det vil sige, at der er behov for, at det faste stofs molekyler absorberer energi i form af varme, så de kan bryde de intermolekylære vekselvirkninger og gå over i damptilstanden. Mængden af involveret varme kan måles ved en termodynamisk størrelse kendt som sublimationsentalpien.
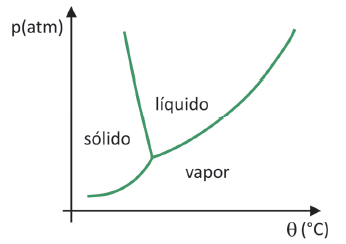
Fasediagram
Til at vide i hvilket tryk- og temperaturinterval sublimeringen af et fast stof vil ske, skal du evaluere dit fasediagram. Lad os se på tilfældet med kuldioxid, CO2.

I et fasediagram samler grænselinjerne mellem tilstande (fast, flydende og gas) tryk- og temperaturværdierne for der sker et tilstandsskifte. Når man observerer tilfældet med CO2, bemærkes det, at ved 1 atmosfæres tryk passerer den faste fase direkte til dampfasen ved en temperatur på -78,5 °C, hvilket kendetegner en sublimering.
Kuldioxid har kun en flydende fase ved tryk over 5,11 atmosfærer, og ud over det tryk er sublimering ikke længere mulig. For at lære mere om fasediagrammet, klik her.
eksempler på sublimering
Tøris: Tøris, der ofte bruges til at lave tågeeffekter ved fester og begivenheder, er faktisk kuldioxid i fast tilstand.

mølkugler: mølkugler er lavet af naphthalen, en aromatisk organisk forbindelse. Det bruges til at fjerne dårlig lugt og også skræmme møl, kakerlakker og andre giftige dyr væk, hvorfor det er almindeligt, at de bruges i skabe eller endda urinaler.

Kamfer: Med en karakteristisk lugt kan kamfersten også undergå sublimering. De tjener også til at skræmme myg væk og forhindre mug.

Jod: det ikke-metal, der hører til halogenerne, gennemgår også sublimering.

Men blandt de præsenterede stoffer, kun kuldioxid undergår sublimering under omgivende forhold. De andre kan, selv med sublimering, gennemgå normal fusion under det pres, vi lever i.
Læs også: Plasma - den fjerde tilstand af stof
Løste øvelser om sublimering
Spørgsmål 1
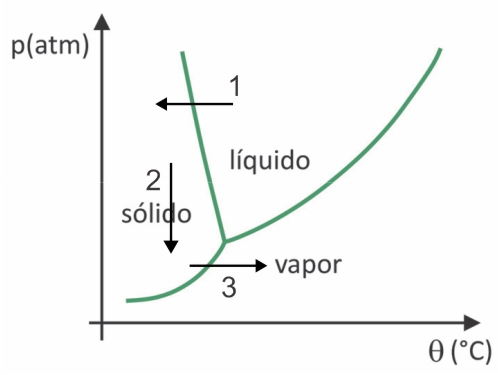
(Fuvest 2020) I supermarkeder er det almindeligt at finde såkaldte frysetørrede fødevarer, såsom frugt, grøntsager og kød. Frysetørrede fødevarer er stadig velegnede til indtagelse efter lang tid, selv uden nedkøling. Udtrykket "lyofiliseret" i disse fødevarer refererer til nedfrysningsprocessen og efterfølgende dehydrering ved vandsublimering. For at vandsublimering kan forekomme, kræves en kombination af betingelser, som vist i tryk-temperatur-grafen, hvor linjerne repræsenterer faseovergange.
På trods af at det er en proces, der industrielt kræver brug af visse teknologier, er der bevis for, at folk præcolumbianere, der boede i Andesbjergene, var i stand til at frysetørre mad, hvilket gjorde det muligt at opbevare det til mere tid. Tjek alternativet, der forklarer, hvordan den naturlige frysetørringsproces foregik:
a) Sublimering af vand skete på grund af lave temperaturer og højt atmosfærisk tryk i bjergene.
b) Mad, efter at have været naturligt nedfrosset i kolde perioder, blev ført til den laveste del af bjergene, hvor det atmosfæriske tryk var lavere, hvilket gjorde sublimering mulig.
c) Maden blev udsat for solen for at øge temperaturen, og det lave lokale atmosfæriske tryk begunstigede størkning.
d) Temperaturerne var lave nok i de kolde perioder til at fryse mad, og det lave atmosfæriske tryk i de høje bjerge gjorde sublimering mulig.
e) Madvarerne blev, efter at de var naturligt frosne, presset for at øge trykket, så sublimering kunne forekomme.
Respons: Bogstav D.
Ved lyofilisering er der frysning af vand med dets efterfølgende sublimering. Præcolumbianske folk kunne udføre en sådan proces, da vandet om vinteren kunne fryse (pil 1) og med lavtrykket (pil 2) i de højeste områder i Andesbjergene, kunne det undergå sublimering (pil 3).
spørgsmål 2
(Uerj 2005) Tøris eller størknet kuldioxid, der er meget brugt i køleprocesser, undergår sublimering under omgivende forhold. Under denne transformation opstår blandt andet fænomenerne energivariation og forstyrrelse af interaktioner.
Disse fænomener er klassificeret som henholdsvis:
a) eksoterm - interionisk
b) eksoterm - internukleær
c) isotermisk - interatomisk
d) endotermisk - intermolekylær
Respons: Bogstav D.
Sublimering er en endoterm proces, da den kræver absorption af varme for at forstyrre de interaktioner, der holder fastfasemolekylerne kompakte. Disse interaktioner er af den intermolekylære type.
Af Stefano Araujo Novais
Kemi lærer


