DET søborgium, symbol Sg og Atom nummer 106, er et syntetisk kemisk grundstof placeret i gruppe 6 i det periodiske system. Dens opdagelse stammer fra 1974 og krediteres den amerikanske gruppe ledet af Albert Ghiorso og som havde bidraget fra Glenn Seaborg, hvis navn stammer fra udtrykket seaborgium. Ligesom mange elementer i denne region af Periodiske system, fik seaborgium først sit navn officielt i 1997 på grund af stridigheder og forhandlinger mellem grupper af videnskabsmænd.
Selvom der er forskere, der er engageret i at studere det, har seaborgium kun lidt praktisk nytte. Dette skyldes vanskelighederne med at syntetisere isotoper af dette element, såvel som deres lave stabilitet. Den mere stabile isotop af seaborgium har for eksempel en halveringstid på cirka fem minutter.
Se også: Dubnium - et andet syntetisk kemisk grundstof i gruppe 6 i det periodiske system
Resumé om seaborgium
- Det er et syntetisk kemisk grundstof placeret i gruppe 6 i det periodiske system.
- Det blev først syntetiseret i 1974 af to forskellige grupper.
- Det er en radioaktivt grundstof.
- Man ved endnu ikke meget om seaborgium, da der sjældent produceres stabile prøver i væsentlige mængder.
- Grundstoffet blev først gjort officielt som seaborgium i 1997 til ære for videnskabsmanden Glenn Seaborg.
Stop ikke nu... Der er mere efter annoncen ;)
egenskaber ved seaborgium
- Symbol: Sg.
- Atom nummer: 106.
- Atommasse: 269 c.u.
- Elektronisk konfiguration: [Rn] 7s2 5f14 6d4.
- Mest kendte isotoper: 269Sg (5 ± 3 minutter halveringstid); 271Sg (3,1 ± 1,6 minutter halveringstid).
- Kemisk serie: gruppe 6; transactinider; super tunge elementer.
Karakteristika for seaborgium
Det er karakteristisk for transactinid-elementer at være radioaktive.. Disse er grundstofferne med et atomnummer større end eller lig med 104 (fra ruterfordium, Rf). Imidlertid var der en uhæmmet søgen efter disse elementer i naturen og teoretisering om "stabilitetens ø".

Det ville repræsentere et supertungt atomområde, hvor antallet af protoner ville være i gennemsnit 114, og elementerne ville have en stor halvt liv (tid, der kræves for prøvemassen at falde til det halve), og præsenterer sig selv som levedygtig og tilgængelig for eksperimentelle undersøgelser.
Der er dog siden 1950'erne gjort så meget som flere bestræbelser på at finde naturlige spor af disse elementer, sagde Georgy Flerov og Gurgen Ter-Akopian i midten af 1980'erne, at de ikke havde noget håb om at finde dem i natur.
Som med andre transactinid-elementer er det vanskeligt at studere seaborgium bredt. Dette pga det er kun muligt at syntetiseresmå mængder, som harmeget kort halveringstid, det vil sige, at der er få atomer og de holder i et par minutter.
Dette gjorde det muligt at bekræfte, at seaborgium faktisk ville være fra gruppe 6, som det var tilfældet med forbindelsen SgO2cl2, som i visse henseender lignede de analoge forbindelser af stabile grundstoffer i gruppen, såsom WO2cl2 og MoO2cl2.
Læs også:Transuraniske grundstoffer - kunstige grundstoffer, der kommer efter uran i det periodiske system
Indhentning af seaborgium
Da seaborgium er et syntetisk grundstof, er det vigtigt at bemærke, at det ikke findes i naturen. En barriere for at opnå seaborgium, udover at det kun er muligt at syntetisere små mængder, er at at opnå det kræver højteknologisk maskineri og ekstreme forhold.
Atomer såsom seaborgium dannes ved reaktionen af Fusion af lettere atomer ved hjælp af ioniske stråler meget høj energi og er kun tilgængelige til undersøgelse i miljøer, der anses for at være fjendtlige over for de fleste kemiske systemer: ved hjælp af en stråle af plasma induceret i store partikelacceleratorer.

Historisk set blev seaborgium syntetiseret gennem kollisionen af ioner18Den (ilt-18), der har 249Jf. (californium-249) som mål. Gennem analysen af alfapartikelhenfald blev syntesen af element 106 således bekræftet.
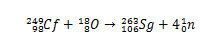
Forholdsregler med Seaborgium
Kemiske grundstoffer som seaborgium udgør ikke store risici, da der ikke produceres nok mængder af dette grundstof til at forblive stabilt i lang tid. Al den omhu, der skal tages, er relateret til radioaktive prøver, der er i stand til at generere ioniserende stråling i henfaldsprocesser.
Få mere at vide: Tjernobyl-ulykke - den største atomulykke i historien
seaborgiums historie
Som andre supertunge grundstoffer, seaborgium blev opdaget i forbindelse med den såkaldte krig om overførsler, et stykke Kold krig i historien om Kemi og det periodiske system.
Denne krig var en strid om præferencen i at navngive kemiske grundstoffer opdaget efter fermium (Fm, Z = 100), mere specifikt mellem grundstoffer med atomnummer 104 til 109, som fandt sted under den kolde krigsperiode.
I denne tvist konkurrerede laboratorierne:
- Fælles Institut for Nuklear Forskning i Dubna (tidligere en del af Sovjetunionen);
- Lawrence Berkeley National Laboratory ved University of California, Berkeley (Forenede Stater);
- Gesellschaft für Schwerionenforschung, i Darmstadt (Tyskland).
Specifikt i tilfældet med seaborgium, den tvist opstod mellem Dubna og Berkeley laboratorierne. Dette skyldes, at begge laboratorier i 1974 hævdede at have formået at syntetisere element 106.
Men en fælles rapport, der indeholdt medlemmer fra både International Union of Pure and Applied Chemistry (IUPAC) og of Pure and Applied Physics (Iupap), lavet i 1993, konkluderede, at selvom det er meget vigtigt for den fremtidige udvikling, du eksperimenter på Dubna-laboratoriet viste ikke dannelsen af element 106 på overbevisende måde og krediterer dermed Berkeley Laboratories for opdagelsen af det nye element.
Iupac Inorganic Compounds Nomenclature Commission (CNIC) foreslog endda navnet rutherfordium for element 106, uden at tage hensyn til forskernes forslag. Efter megen diskussion, Berkeley Labs-teamet, ledet af Albert Ghiorso, besluttede, hvad navnet angår, at hædre kollegaen Glenn Theodore Seaborg, PNobel pris i kemi i 1951, og navngav grundstoffet seaborgium.
Hans søn Eric Seaborg fortalte endda i en artikel sin fars reaktion på ideen:
Ghiorso henvendte sig til teammedlemmerne én efter én, indtil syv af dem nikkede. Så fortalte han sin ven og kollega gennem 50 år: ”Vi har syv stemmer for at udnævne grundstof 106 til havborgium. Vil du acceptere?". Min far var forbløffet, og efter at have rådført sig med min mor, accepterede han.
Løste øvelser på seaborgium
Spørgsmål 1
Seaborgium har en isotop, masse 269, hvis estimerede halveringstid er 5 minutter. I et eksperiment for dets syntese var forskerne i stand til efter 25 minutter at påvise 0,0025 mg af isotopen 269 af seaborgium. Den oprindelige masse af seaborgium var:
A) 0,0025 mg
B) 0,0050 mg
C) 0,0100 mg
D) 0,0200 mg
E) 0,0800 mg
Løsning:
Alternativ E
Halveringstiden er den tid, det tager for mængden af en radioaktiv prøve at falde til det halve. Inden for 25 minutter var der 5 halveringstider for seaborgium. Det er således muligt at lave en retroaktiv analyse:
- 0,0050 mg til 0,0025 mg (5. halveringstid)
- 0,0100 mg til 0,0050 mg (4. halveringstid)
- 0,0200 mg til 0,0100 mg (3. halveringstid)
- 0,0400 mg til 0,0200 mg (2. halveringstid)
- 0,0800 mg til 0,0400 mg (1. halveringstid)
spørgsmål 2
I 1974, i Berkeley, Californien, lykkedes det gruppen ledet af Albert Ghiorso at syntetisere element 106 under den velkendte Transfer War, en del af den kolde krig i kemiens historie. Dette nye grundstof havde, udover atomnummer 106, et massetal på 263. I 1997 blev han officielt søborgium, med henvisning til Ghiorsos ven og kollega Glenn Seaborg, vinder med Nobelprisen i kemi i 1951 og også medlem af gruppen, der formåede at syntetisere det nye element.
Ud fra de præsenterede data er det muligt at konkludere, at antallet af neutroner i det syntetiserede seaborgium er lig med:
A) 155
B) 157
C) 159
D) 106
E) 263
Løsning:
Alternativ B
Antallet af neutroner af et atom kan beregnes som følger:
A = Z + n
A er antallet af pasta, Z er atomnummeret og n er antallet af neutroner.
Ved at erstatte dataene fra spørgsmålet har vi:
263 = 106 + n
n = 157
Af Stefano Araújo Novais
Kemi lærer



