Elektrolyse det er en ikke-spontan proces, det vil sige en proces, der ikke forekommer naturligt, hvor stoffer dannes ved hjælp af en elektrisk afladning i forbindelser smeltet eller opløst i vand. I denne proces når en elektrisk strøm til en glasbeholder (elektrolytisk tank), der har to inaktive elektroder (som ikke lider eller oxidation heller ikke reduktion) dannet af grafit eller platin. Disse elektroder er forbundet til en elektrisk kilde (normalt en trommer) og dyppes i et salt eller en base smeltet eller opløst i vand. Ligesom batteri, har elektrolyse en katode (hvor reduktion forekommer) og en anode (hvor oxidation forekommer).
Resumé
Elektrolyse er en ikke-spontan proces;
Enkle eller sammensatte stoffer kan dannes;
Det kan forekomme med et smeltet opløst stof (magtfuld elektrolyse);
Det kan forekomme med et opløst stof opløst i vand (vandig elektrolyse);
En kation gennemgår altid reduktion ved katoden;
En anion gennemgår altid oxidation ved anoden.
Se også:Opnåelse af aluminium fra elektrolyse

Typer af elektrolyse
Det er en elektrolyse, der opstår, når en elektrisk afladning udføres på en smeltet ionisk forbindelse. Den ioniske forbindelse er en dannet af en ionbinding, såsom en salt eller a grundlag uorganisk. Når vi taler om smeltet forbindelse henviser vi igen til den forbindelse, der går fra et faststof til en flydende tilstand.
- Eksempel på magmatisk elektrolyse
Når vi udfører fusionen af kaliumchlorid (KCl), gennemgår dette salt dissociationsprocessen og frigiver kaliumkationen (K+) og iodidanionen (l-).

Dissociationsligning for kaliumchlorid
Når den elektriske strøm når den elektrolytiske celle med disse ioner, reduceres kaliumkationen og danner metallisk kalium (K), og iodidanionen oxideres og danner fast iod (I2).
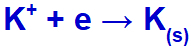
Fast ligning af kaliumdannelse
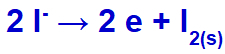
Fast ioddannelsesligning
Det er en elektrolyse, der opstår, når den elektriske afladning udføres på en vandig opløsning (har vand) dannet af et salt eller en uorganisk base.
- Eksempel på vandig elektrolyse
Når vi opløser natriumchlorid i vand, adskiller det sig, og vandet gennemgår ionisering:

Vandionisering og natriumchlorid dissociationsligninger
Som natriumkation (Na+) tilhører IA-familien, hydroniumkationen (H+) passerer gennem udledningen og gennemgår reduktion og danner brintgas (H2).
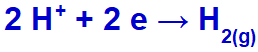
Ligning af brintgasdannelse
Som chlorid (Cl-) er ikke iltet (har ikke ilt) og er ikke fluor (F-), udledes den, oxiderer og danner chlorgas (Cl2).

Klorgasdannelsesligning
Selektiv ionudledning
Under en elektrolyseproces i et vandigt medium (opløsning dannet af vand og et opløst stof) vil vi altid have to kationer: hydronium, fra vand og ethvert andet, fra salt dissociation (et eksempel på en opløst stof). Vi vil også have to anioner: hydroxyl, der kommer fra vand, og en anden, der kommer fra salt.

Ioner fra vandionisering og saltdissociation
- Selektiv udledning til kationer og anioner
Hvis kationen fra det opløste stof hører til IA-, IIA- eller IIIA-familien, er hydronium (H+) reduceres
Hvis kationen, der kommer fra det opløste stof, ikke tilhører de ovennævnte familier, vil det lide under reduktionen.
Hvis anionen fra det opløste stof har ilt i sin sammensætning eller er et fluor (F-), hydroxidet (OH-) vil gennemgå oxidation;
Hvis anionen fra det opløste stof ikke har de ovennævnte egenskaber, gennemgår den oxidation.
Det er kendt, at vand har evnen til at selvionisere, hvilket producerer hydroniumioner (H+) og hydroxid (OH-), men denne ionisering er ret begrænset. Denne kendsgerning er bevist ved ineffektiviteten af rent vand til at lede elektrisk strøm.
Såsom elektrolyse involverer elektrisk afladning, for at udføre elektrolyse af vand er det nødvendigt at opløse et opløst stof, det som favoriserer selektiv udledning af hydronium og hydroxid (som det ses i emnet om udledning selektiv).
Hvis vi tilsætter natriumsulfat (Na2KUN4), for eksempel vil vi have natriumkationerne i midten (Na+) og hydronium (H+) samt hydroxidanioner (OH-) og sulfat (SO4-2). Således når den elektriske strøm ankommer til den elektrolytiske tank:
hydroniet vil blive udledt og reducere, fordi natrium tilhører IA-familien;
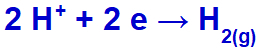
Ligning af brintgasdannelse
hydroxidet gennemgår udledning, oxiderer, fordi sulfatet har ilt i sin sammensætning.
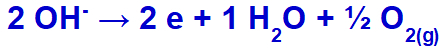
Oxygengasdannelsesligning
Da de to ioner (kation og anion), der kommer fra vandet, blev udledt, siger vi, at elektrolysen af vandet fandt sted.
Se også: Kvantitative aspekter af elektrolyse
Produktion af enkle stoffer såsom hydrogengas (H2), iltgas (O2) etc.;
Produktion af sammensatte stoffer såsom natriumhydroxid (NaOH), svovlsyre (H2KUN4) etc;
Belægning af en del med et bestemt metal, såsom kobber (kobber) og guld (forgyldning);
Brug til at fjerne et bestemt metal fra din malm.
Løste øvelser i elektrolyse
Eksempel 1 - (Vunesp) En vandig opløsning af CuC32 udsættes for elektrolyse under anvendelse af platinelektroder. Den korrekte erklæring er:
a) Cu-ionreduktion sker ved katoden2+.
b) Cu-ionoxidation forekommer ved anoden2+.
c) Der dannes klorgas ved katoden.
d) En del af platinanoden opløses og danner Pt2+.
e) Produkterne fra denne elektrolyse ville være forskellige, hvis elektrolysen af CuCl2 var flammende (fusion).
a) Korrekt. Når CuCl2 er opløst i vand, har vi hydroniumkationerne (H+) og kobber II (Cu+2). Da kobber II-kationen ikke tilhører IA-, IIA- og IIIA-familierne, reduceres den.
b) Falsk, da chloridanionen (Cl) oxideres ved anoden-), som ikke har ilt i sin sammensætning og ikke er fluor (F-).
c) Falsk, fordi reduktionen af kobber II-kationen sker ved katoden, er der således dannelsen af kobbermetallet.
d) Falsk, da platin- eller grafitelektroder i elektrolyse kun leder elektricitet, deltager de ikke i processen.
e) Falsk som den magtfulde elektrolyse af kobberchlorid II (CuCl2) ville præsentere nøjagtigt de samme produkter som den vandige, da de tilstedeværende ioner ville være kobber II (Cu+2og chloridet (Cl-1).
Eksempel 2- (UFRN) Overvej følgende systemer:
JEG. Smeltet natriumchlorid;
II. Vandig natriumchloridopløsning;
III. Smeltet natriumhydroxid;
IV. Vandig natriumhydroxidopløsning.
De, der kan tilvejebringe natrium, når de udsættes for elektrolyse, er:
a) kun I og II.
b) kun I og III.
c) kun II og IV.
d) kun III og IV.
e) I, II, III og IV.
Systemerne, der leverer metallisk natrium som produkt ved katoden, er I og III.
I- Den eneste kation, der er til stede i mediet, er natriumkationen, derfor kan kun den reducere og danne metallisk natrium.
II- Dette system giver ikke metallisk natrium, fordi natriumchloridet blev opløst i vand, derfor har vi i midten tilstedeværelsen af natriumkationer (Na+) og hydronium (H+) - dette er den, der lider af reduktionen, da natrium tilhører IA-familien.
III- Den eneste kation, der er til stede i mediet, er natriumkationen (fordi materialet er blevet udsat for en fusion), derfor gennemgår det kun reduktion og danner metallisk natrium;
IV- Dette system leverer ikke metallisk natrium, fordi natriumhydroxidet blev opløst i vand, så i midten har vi tilstedeværelse af natriumkationer (Na+) og hydronium (H+) - dette er den, der lider af reduktionen, da natrium tilhører IA-familien.
Af mig. Diogo Lopes Dias

