Det vigtigste kendetegn ved redoxreaktioner er, at én kemisk art samtidig mister elektroner (ved at oxidere), og en anden får elektroner (ved at reducere).
Men i visse reaktioner er det muligt at observere, at der ikke kun er en oxidation og/eller reduktion. Nedenfor er et eksempel:
SnS + HCl + HNO3 → SnCl4 + S + NO + H2O
Ved at beregne oxidationstallene (Nox) for alle atomer i denne reaktion, som beskrevet i teksten "Bestemmelse af oxidationstallet (Nox)", har vi:
+2 -2 +1 -1 +1 +5 -2 +4 -1 0 +2 -2 +1 -2
SnS + HCl + HNO3 → SnCl4 + S + NO + H2O
Lad os nu tjekke hvilkestoffer havde variationer i deres Nox og som følge heraf oxiderede og reducerede:
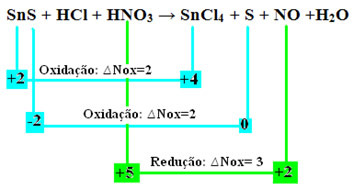
Bemærk, at der er sket to oxidationer. Så hvordan balancerer man i så fald den kemiske ligning?
En vigtig ting at huske på, der gælder for alle redoxreaktioner, er det antallet af bortgivne elektroner skal altid svare til antallet af modtagne elektroner.
Derfor, for at afbalancere denne type reaktion, følg de samme regler, der er fastsat i teksten "Redox balancering
” dog med kun én ændring: Bestemmelsen af Nox-variationen (∆Nox) af arten, der genererede de to oxidationer (SnS), vil være summen af de to ∆Nox, som vil give os den samlede værdi af tabte elektroner:- SnS: ∆Total Nox = (∆Nox SnCl4) + (∆Nox S)
SnS: ∆Total NOx = 2 + 2 = 4
- HNO3: ∆Nox = 3
Så vi kan fortsætte med følgende trin til balancering:
Stop ikke nu... Der er mere efter reklamen ;)
- SnS: ∆Total NOx = 4 → 4 vil være HNO-koefficienten3;
- HNO3: ∆Nox = 3 → 3 vil være koefficienten for SnS.
3 SnS + HCl+ 4 HNO3 → SnCl4 + S + NO + H2O
Fortsættelse af balanceringen ved prøvemetode:
- Da du har 3 Sn og 3 S i 1. medlem, vil disse også være dine koefficienter i 2. medlem:
3 SnS + HCI + 4 HNO3 → 3 SnCl4 + 3 Y+NEJ+H2O
- Med det stod 2. medlem tilbage med 12 Cl (3. 4 = 12), så 12 vil være koefficienten for det stof, hvori Cl findes i det 1. medlem, som er HCl:
3 SnS+ 12 HCI + 4 HNO3 → 3 SnCl4 + 3S + NO +H2O
- Vi har nu 16 H i 1. medlem (12 + 4 = 16), deraf koefficienten for H2O vil være lig med 8, fordi 8 ganget med brintindekset, som er 2, giver 16:
3 SnS + 12 HCl + 4 HNO3 → 3 SnCl4 + 3 S + NO +8H2O
- Ydermere er der i 1. medlem også 4 N, så 4 vil også være koefficienten for N i 2. medlem:
3 SnS + 12 HCl + 4 HNO3 → 3 SnCl4 + 3 S + 4 NO + 8 H2O
Bemærk, at mængden af ilt i 1. lem (3. 4 = 12) er lig med den samlede mængde af det element i 2. lem (4 + 8 = 12). Så reaktionen er afbalanceret.
Af Jennifer Fogaça
Uddannet i kemi
Vil du referere til denne tekst i et skole- eller akademisk arbejde? Se:
FOGAÇA, Jennifer Rocha Vargas. "Reaktioner med mere end én oxidation og/eller reduktion"; Brasilien skole. Tilgængelig i: https://brasilescola.uol.com.br/quimica/reacoes-com-mais-uma-oxidacao-ou-reducao.htm. Tilgået den 27. juli 2021.


