Polymerisation er navnet på den kemiske proces, der resulterer i dannelsen af makromolekyler (store molekyler) kaldet polymerer, gennem kombinationen af mindre molekyler, monomererne.
reaktionen af polymerisation det er meget almindeligt i naturen, som vi kan se i kulhydrater (som stivelse) og proteiner (som kasein i mælk). Det forekommer også syntetisk, da langt de fleste polymerer, der bruges af mennesker i deres daglige liv, er fremstillet kunstigt.
Den første polymer fremstillet af polymerisation syntetisk var bakelit, i 1909, af den belgiske kemiker Leo Hendrik Baekeland.
Generelt for at en monomer skal kombineres med en anden (uanset om de er ens eller forskellige) i en reaktion af polymerisation, er det nødvendigt eksistensen af fri valens (kemisk binding, der skal udføres) i begge monomerer.
Disse valenser opstår som et resultat af brydning af bindinger ved brug af katalysatorer (såsom nikkel), ydre forhold som lys og varme, eller ved fænomenet resonans i strukturen (elektronforskydning).
I dannelsen af polypropylen (PP-polymer), for eksempel, der anvendes i husholdningsredskaber og legetøj pi link (π) i hvert molekyle er opdelt som følger:
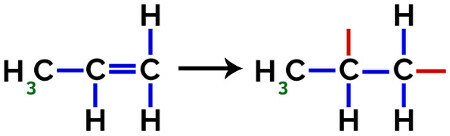
Brud af pi-binding i propylen
Således kan hver propylenmonomer binde med to andre propylenmonomerer og danne polymeren PP eller polypropylen (præfikset poly angiver flere monomere enheder). Den hyppigste måde at repræsentere en polymer på har monomeren mellem parenteser og på ydersiden bogstavet n, som angiver flere monomerer, som vi kan se i tilfældet med PP-polymeren:
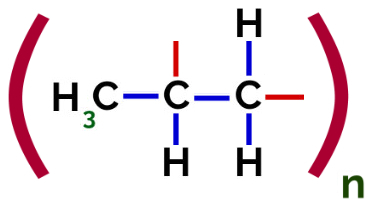
Repræsentation af PP-polymer
reaktionen af polymerisation kan gøres på forskellige måder, som vi vil se nedenfor:
a) Reaktion af additionspolymerisation
Heri polymerisation, er der altid et brud på en pi-binding i monomeren, hvilket får to frie valenser til at opstå i strukturen, som ved dannelsen af polyethylen, polymer udbredt i farmaceutisk emballage.
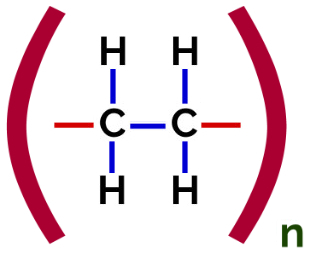
Polyethylen Addition Polymer Strukturformel
På polymerisation af polyethylen anvendes molekyler af ethylen (ethen), som har en pi-binding mellem de to carbonatomer, som monomer. Når denne binding brydes, vises to frie valenser, en på hvert carbonatom, der var involveret i pi-bindingen. Monomererne forenes nøjagtigt i hver af disse valenser, det vil sige, at den enes valens er knyttet til den andens valens, og så videre.
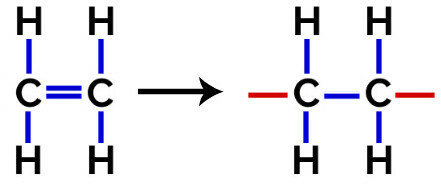
Polyethylendannelsesligning
b) Additionspolymerisationsreaktion 1.4
I denne polymerisation præsenterer monomererne to alternerende dobbeltbindinger (en pi og en sigma), hvilket favoriserer fænomenet af resonans (skiftende position af pi-elektronerne i pi-bindingen), som i dannelsen af syntetisk gummi (polybutadien)

Strukturel formel af polybutadien
Den monomere enhed af denne polymer er butadien, som har to alternerende dobbeltbindinger. Med resonans har strukturen en dobbeltbinding mellem kulstof 2 og 3 og to frie valenser på kulstof 1 og 4. Det er netop i disse frie valenser af kulstof 1 og 4, at monomererne kombineres.

Butadien resonans
c) Reaktion af kondensationspolymerisation eller eliminering
Det er en reaktion af polymerisation hvori, obligatorisk, to monomerer (ens eller forskellige) samtidig mister atomer eller grupper, hvilket resulterer i to frie valenser i hver af dem. På denne måde sker der altid en eliminering af brint fra en monomer, som så forbindes med et halogen (F, Cl, Br, I), OH, NH2eller til CN af den anden monomer.
Så i polymerisation ved eliminering er der altid dannelse af vand, halogeneret syre (HCl, HI, HF, HBr), ammoniak (NH)3) eller blåsyre (HCN) ud over polymeren. Se for eksempel repræsentationen af dannelsen af polyester, et materiale, der bruges som stof:

Polyester dannelsesligning
Polyesterdannende monomerer er p-benzendisyre og ethan-1,2-diol. Det kan vi konstatere i dette polymerisation elimineringen af vandmolekyler sker, da de to monomerer har to hydroxyler. I denne proces mister syren de to hydroxyler, og dialkoholen mister kun brinten fra sine hydroxyler:

Polyester struktur
Polyestermonomerer er forbundet af oxygenet i alkoholen og kulstoffet i carboxylsyren.
Af mig Diogo Lopes Dias
Kilde: Brasilien skole - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-polimerizacao.htm
