DET pastaatomar, som navnet antyder, er det massen af et atom, normalt symboliseret med "mDet” eller “MA”. Men da atomet er en ekstrem lille enhed, usynlig for menneskelige øjne, er det ikke muligt at måle dets masse ved hjælp af for eksempel skalaer. Så videnskabsmænd bestemte massen af atomer ved at sammenligne dem med masserne af andre atomer.
Dette gøres også med de andre enheder. For eksempel er masseenheden standardkilogrammet, hvilket svarer til en cylinder på 3,917 cm i højden og diameteren, lavet af 10% iridium og 90% platin. Så det tjener som en sammenligning. For eksempel, hvis vi "vejer" en genstand på en vægt, og vi finder ud af, at dens masse er 10 kg, betyder det, at dens masse er 10 gange større end den valgte standard: 1 kg.
Det samme gælder for atomer. Den valgte standard var carbon-12, og dette atom blev vilkårligt tildelt en masse på 12 u. "u" er enheden for atommasse og svarer derfor til 1/12 af massen af et kulstofatom.
For eksempel, når vi siger, at brints atommasse er lig med 1 u, betyder det, at det er som om hvis vi deler kulstoffet i 12 dele, svarer massen af en af disse dele til massen af atomet i brint. Et andet eksempel er svovl, dets atommasse er 32 u, hvilket betyder, at dets masse er 32 gange større end 1/12 af massen af
12Ç.1 u = 1/12 af massen af 1 carbonatom 12

Atommasseenheden er 1/12 af massen af kulstof-12
Stoffers molekylmasse er summen af grundstoffernes atommasse. For eksempel er iltens atommasse lig med 16 u, så iltgasmolekylets molekylmasse (O2) er lig med 32u.
Da laboratorieteknikker i øjeblikket er meget avancerede, er der enheder, der nøjagtigt måler grundstoffernes atommasse, såsom massespektrometeret. Det er således muligt at vide det 1 u er lig med 1,66054. 10-24 g.
Mind Map: Atommasse
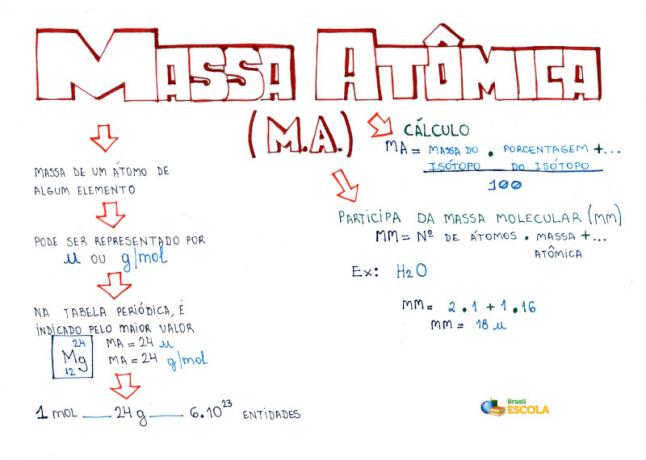
*For at downloade tankekortet i PDF, Klik her!
Da atommasser bestemmes med stor præcision, er de angivet i det periodiske system i form af decimaltal. Men når vi skal lave beregningerne, bruger vi normalt det afrundede tal, med undtagelse af eksperimenter, der skal være meget præcise. Hvis du for eksempel ser på det periodiske system, vil du se, at iltens atommasse er lig med 15.999 u, men vi bruger generelt værdien 16 u i beregningerne. Dette sker også med kulstof, hvis atommasse er givet ved 12,01 u, som vist nedenfor:
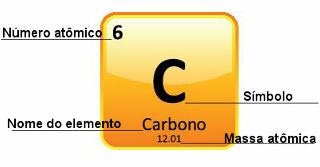
Repræsentation af kulstof i det periodiske system
De grundstoffer, der optræder i det periodiske system, er faktisk det vægtede gennemsnit af alle grundstoffets naturlige isotoper. Således er atommassen, der vises i tabellen, også gennemsnittet af disse grundstoffers atommasse. For eksempel har klor (C?) to naturlige isotoper, 35 og 37, hvis respektive procentdele i naturen er 75,76 % og 24,24 %. Atommasserne for hver af disse isotoper er forskellige, idet den for Cβ-35 er 34,96885 u og den for Cβ-37 er 36,96590.
På denne måde beregnes grundstoffets atommasse under hensyntagen til massen af hver isotop og den overflod, hvormed den optræder i naturen. I tilfælde af klor har vi:
Atommasse af grundstoffet klor = (34,96885. 75,76%) + (36,96590. 24,24%)
100%
Atommasse af grundstoffet klor = 35,45
Dette er atommasseværdien af klor, der vises i det periodiske system.
* Mind Map af Me. Diogo Lopes
Af Jennifer Fogaça
Uddannet i Bogstaver
Kilde: Brasilien skole - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-massa-atomica.htm

![Pafnut[i/y] Lvovic[h] Chebyshev [eller Tchebycheff]](/f/7a0ba16d3339d52888058997e484c0cb.jpg?width=680&height=460)
